Glifo para el tratamiento de la diabetes
Nombre de la marca: Glyset
Nombre genérico: miglitol
Contenido:
Descripción
Farmacología Clínica
Estudios clínicos
Indicaciones y uso
Contraindicaciones
Precauciones
Reacciones adversas
Sobredosis
Dosificación y administración
Cómo se suministra
Glifo, miglitol, información del paciente (en inglés simple)
Descripción
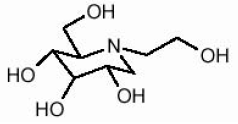
Las tabletas GLYSET contienen miglitol, un inhibidor oral de la alfa-glucosidasa para usar en el tratamiento de la diabetes mellitus no dependiente de insulina (NIDDM). El miglitol es un derivado de desoxinojirimicina y se conoce químicamente como 3,4,5-piperidinetriol, 1- (2-hidroxietil) -2- (hidroximetil) -, [2R- (2Î ±, 3β, 4Î ±, 5β)] -. Es un polvo blanco a amarillo pálido con un peso molecular de 207.2. Miglitol es soluble en agua y tiene un pKa de 5.9. Su fórmula empírica es C8H17NO5 y su estructura química es la siguiente:
GLYSET está disponible en tabletas de 25 mg, 50 mg y 100 mg para uso oral. Los ingredientes inactivos son almidón, celulosa microcristalina, estearato de magnesio, hipromelosa, polietilenglicol, dióxido de titanio y polisorbato 80.
parte superior
Farmacología Clínica
El miglitol es un derivado de desoxinojirimicina que retrasa la digestión de los carbohidratos ingeridos, lo que resulta en un aumento menor en la concentración de glucosa en sangre después de las comidas. Como consecuencia de la reducción de la glucosa en plasma, las tabletas GLYSET reducen los niveles de hemoglobina glucosilada en pacientes con diabetes mellitus tipo II (no dependiente de insulina). La glucosilación de proteínas no enzimáticas sistémicas, como se refleja en los niveles de hemoglobina glucosilada, es una función de la concentración promedio de glucosa en sangre a lo largo del tiempo.
Mecanismo de acción
A diferencia de las sulfonilureas, GLYSET no mejora la secreción de insulina. La acción antihiperglucémica del miglitol resulta de una inhibición reversible de las enzimas ß-glucósidos hidrolasas intestinales unidas a la membrana. Las α-glucosidasas intestinales unidas a la membrana hidrolizan oligosacáridos y disacáridos a glucosa y otros monosacáridos en el borde en cepillo del intestino delgado. En pacientes diabéticos, esta inhibición enzimática produce una absorción de glucosa retardada y una disminución de la hiperglucemia posprandial.
Debido a que su mecanismo de acción es diferente, el efecto de GLYSET para mejorar el control glucémico es aditivo al de las sulfonilureas cuando se usa en combinación. Además, GLYSET disminuye los efectos insulinotrópicos y de aumento de peso de las sulfonilureas.
El miglitol tiene una actividad inhibitoria menor contra la lactasa y, en consecuencia, a las dosis recomendadas, no se espera que induzca intolerancia a la lactosa.
Farmacocinética
Absorción
La absorción de miglitol es saturable a dosis altas: una dosis de 25 mg se absorbe por completo, mientras que una dosis de 100 mg es solo del 50% al 70%. Para todas las dosis, las concentraciones máximas se alcanzan en 2-3 horas. No hay evidencia de que la absorción sistémica de miglitol contribuya a su efecto terapéutico.
Distribución
La unión a proteínas del miglitol es insignificante (<4.0%). El miglitol tiene un volumen de distribución de 0.18 L / kg, consistente con la distribución principalmente en el líquido extracelular.
Metabolismo
Miglitol no se metaboliza en el hombre ni en ninguna especie animal estudiada. No se han detectado metabolitos en plasma, orina o heces, lo que indica una falta de metabolismo sistémico o pre-sistémico.
Excreción
Miglitol se elimina por excreción renal como fármaco inalterado. Por lo tanto, después de una dosis de 25 mg, más del 95% de la dosis se recupera en la orina dentro de las 24 horas. A dosis más altas, la recuperación acumulativa del fármaco de la orina es algo menor debido a la biodisponibilidad incompleta. La vida media de eliminación de miglitol del plasma es de aproximadamente 2 horas.
Poblaciones Especiales
Insuficiencia renal
Debido a que miglitol se excreta principalmente por los riñones, se espera la acumulación de miglitol en pacientes con insuficiencia renal. Pacientes con aclaramiento de creatinina 60 ml / min. El ajuste de la dosis para corregir el aumento de las concentraciones plasmáticas no es factible porque el miglitol actúa localmente. Hay poca información disponible sobre la seguridad de miglitol en pacientes con aclaramiento de creatinina <25 ml / min.
Deterioro hepático
La farmacocinética de miglitol no se alteró en pacientes cirróticos en relación con sujetos de control sanos. Como el miglitol no se metaboliza, no se espera ninguna influencia de la función hepática en la cinética del miglitol.
Género
No se observaron diferencias significativas en la farmacocinética de miglitol entre hombres y mujeres de edad avanzada cuando se tuvo en cuenta el peso corporal.
Carrera
Se realizaron varios estudios farmacocinéticos en voluntarios japoneses, con resultados similares a los observados en caucásicos. Un estudio que comparó la respuesta farmacodinámica a una dosis única de 50 mg en voluntarios sanos negros y caucásicos indicó respuestas similares de glucosa e insulina en ambas poblaciones.
parte superior
Estudios clínicos
Experiencia clínica en pacientes con diabetes mellitus no insulinodependiente (NIDDM) en tratamiento dietético únicamente
Las tabletas GLYSET se evaluaron en dos estudios de monoterapia de dosis fija y no controlados en los EE. UU. Y en los EE. UU., En los que 735 pacientes tratados con GLYSET fueron evaluados para análisis de eficacia (ver Tabla 1).
En el Estudio 1, un estudio de un año en el que GLYSET se evaluó como monoterapia y también como terapia combinada, hubo una estadística aumento significativamente menor de la hemoglobina glucosilada media (HbA1c) con el tiempo en el grupo de monoterapia con miglitol 50 mg 3 veces al día en comparación a placebo. Se observaron reducciones significativas en los niveles medios de glucosa plasmática en ayunas y posprandial y en los niveles medios de insulina posprandial en pacientes tratados con GLYSET en comparación con el grupo placebo.
En el Estudio 2, un estudio de 14 semanas, hubo una disminución significativa en la HbA1c en pacientes que recibieron GLYSET 50 mg 3 veces al día o 100 mg 3 veces al día en comparación con el placebo. Además, hubo reducciones significativas en la glucosa plasmática posprandial y los niveles de insulina sérica posprandial en comparación con el placebo.
El estudio 3 fue un ensayo de seis meses de duración que evaluó GLYSET a dosis de 25 mg 3 veces al día a 200 mg 3 veces al día. GLYSET produjo una mayor reducción de HbA1c que el placebo en todas las dosis, aunque el efecto fue estadísticamente significativo solo con las dosis de 100 mg 3 veces al día y 200 mg 3 veces al día. Además, todas las dosis de GLYSET produjeron reducciones significativas en la glucosa plasmática posprandial y los niveles de insulina posprandial en comparación con el placebo.
Los estudios 4 y 5 fueron estudios de 6 meses que evaluaron GLYSET a 50 y 100 mg 3 veces al día y 100 mg 3 veces al día, respectivamente. En comparación con el placebo, GLYSET produjo reducciones significativas en la HbA1c, así como una reducción significativa en la glucosa plasmática posprandial en ambos estudios a las dosis empleadas.
Tabla 1 Resultados del estudio de monoterapia con Glyset
| Estudiar | Tratamiento | HbA1c (%) | Glucosa posprandial de 1 hora (mg / dL) | |
| Cambio medio respecto al valor basal * | Efecto del tratamiento ** | Cambio medio desde el inicio | Efecto del tratamiento ** | |
| 1 (EE. UU.) | Placebo | +0.71 | +24 | |
| GLYSET 50 mg t.i.d. *** | +0.13 | -0.58†| -39 | -63†|
| 2 (EE. UU.) | Placebo | +0.47 | +15 | |
| GLYSET 50 mg t.i.d. | -0.22 | -0.69†| -52 | -67†|
| GLYSET 100 mg t.i.d. | -0.28 | -0.75†| -59 | -74†|
| 3 (no estadounidenses) | Placebo | +0.18 | +2 | |
| GLYSET 25 mg t.i.d. | -0.08 | -0.26 | -33 | -35†|
| GLYSET 50 mg t.i.d. | -0.22 | -0.40 | -45 | -47†|
| GLYSET 100 mg t.i.d. | -0.63 | -0.81†| -62 | -64†|
| GLYSET 200 mg t.i.d.C | -0.84 | -1.02†| -85 | -87†|
| 4 (no estadounidenses) | Placebo | +0.01 | +8 | |
| GLYSET 50 mg t.i.d. | -0.35 | -0.36†| -20 | -28†|
| GLYSET 100 mg t.i.d. | -0.57 | -0.58†| -25 | -33†|
| 5 (no estadounidenses) | Placebo | +0.32 | +17 | |
| GLYSET 100 mg t.i.d. | -0.43 | -0.75†| -38 | -55†|
| * La línea de base promedio varió de 7.54 a 8.72% en estos estudios. ** El resultado de restar el promedio del grupo placebo. *** t.i.d. = 3 veces al día †p â ‰ ¤ 0.05 C Aunque los resultados de 200 mg 3 veces al día se presentan completos, la dosis máxima recomendada de GLYSET es de 100 mg 3 veces al día. |
Experiencia clínica en pacientes con DMNID que reciben sulfonilureas
GLYSET se estudió como terapia complementaria en un contexto de tratamiento con sulfonilurea (SFU) máxima o casi máxima en tres grandes, Estudios aleatorios doble ciego (dos de EE. UU. y uno no estadounidense) en los que se evaluó la eficacia de 471 pacientes tratados con GLYSET (ver Tabla 2).
El estudio 6 incluyó pacientes en tratamiento con dosis máximas de SFU al ingreso. Al final de este estudio de 14 semanas, los efectos medios del tratamiento sobre la hemoglobina glucosilada (HbA1c) fueron de -0.82% y -0.74% para pacientes que reciben GLYSET 50 mg 3 veces al día más SFU, y GLYSET 100 mg 3 veces al día más SFU, respectivamente.
El Estudio 7 fue un estudio de un año en el que se añadió GLYSET a 25, 50 o 100 mg 3 veces al día a una dosis máxima de gliburida (10 mg dos veces al día). Al final de este estudio, los efectos medios del tratamiento sobre HbA1c de GLYSET cuando se agrega a la gliburida máxima la terapia fue -0.30%, -0.62% y -0.73% con las dosis de 25, 50 y 100 mg 3 veces al día de GLYSET, respectivamente.
En el Estudio 8, la adición de GLYSET 100 mg 3 veces al día a un fondo de tratamiento con gliburida produjo un efecto medio adicional del tratamiento sobre HbA1c de -0.66%.
Tabla 2: Resultados de la terapia combinada con GLYSET Plus Sulfonylurea (SFU)
| Estudiar | Tratamiento | HbA1c (%) | Glucosa posprandial de 1 hora (mg / dL) | |
| Cambio medio respecto al valor basal * | Efecto del tratamiento ** | Cambio medio desde el inicio | Efecto del tratamiento ** | |
| 6 (EE. UU.) | Placebo + SFU | +0.33 | -1 | |
| GLYSET 50 mg t.i.d. *** + SFU | -0.49 | -0.82†| -69 | -68†|
| GLYSET 100 mg t.i.d. + SFU | -0.41 | -0.74†| -73 | -72†|
| 7 (EE. UU.) | Placebo + SFU | +1.01 | 48 | |
| GLYSET 25 mg t.i.d. + SFU | +0.71 | -0.30 | -2 | -50†|
| GLYSET 50 mg t.i.d. + SFU | +0.39 | -0.62†| -13 | -61†|
| GLYSET 100 mg t.i.d. + SFU | +0.28 | -0.73†| -33 | -81†|
| 8 (no estadounidenses) | Placebo + SFU | +0.16 | +10 | |
| GLYSET 100 mg t.i.d. + SFU | -0.50 | -0.66†| -36 | -46†|
| * La línea de base promedio varió de 8.56 a 9.16% en estos estudios. ** El resultado de restar el promedio del grupo placebo. *** t.i.d. = 3 veces al día â € p â ‰ ¤ 0,05 |
Respuesta a la dosis
Los resultados de los estudios controlados de dosis fija de Glyset como monoterapia o como tratamiento combinado con una sulfonilurea se combinaron para obtener una estimación agrupada de la diferencia con respecto al placebo en el cambio medio desde el inicio en la hemoglobina glucosilada (HbA1c) y la glucosa plasmática posprandial como se muestra en las Figuras 1 y 2:
Figura 1: Cambio medio de HbA1c (%) desde el inicio: resultados agrupados del efecto del tratamiento de los estudios controlados de dosis fija en las tablas 1 y 2

Figura 2: Cambio promedio de glucosa en plasma posprandial de 1 hora desde el inicio: resultados combinados del efecto del tratamiento de los estudios controlados de dosis fija en las tablas 1 y 2

Debido a su mecanismo de acción, el efecto farmacológico primario del miglitol se manifiesta como una reducción de la glucosa plasmática posprandial, como se mostró anteriormente en todos los ensayos clínicos principales. GLYSET fue estadísticamente significativamente diferente del placebo en todas las dosis en cada uno de los estudios individuales con respecto al efecto en una media de glucosa en plasma posprandial de una hora, y hay una respuesta a la dosis de 25 a 100 mg 3 veces al día para esta eficacia parámetro.
parte superior
Indicaciones y uso
Las tabletas Glyset, como monoterapia, están indicadas como un complemento de la dieta para mejorar el control glucémico en pacientes con diabetes mellitus no insulinodependiente (DMNID) cuya hiperglucemia no se puede controlar con dieta sola Glyset también puede usarse en combinación con una sulfonilurea cuando la dieta más Glyset o una sulfonilurea sola no dan como resultado un control glucémico adecuado. El efecto de Glyset para mejorar el control glucémico es aditivo al de las sulfonilureas cuando se usa en combinación, presumiblemente porque su mecanismo de acción es diferente.
Al iniciar el tratamiento para la NIDDM, se debe enfatizar la dieta como la forma principal de tratamiento. La restricción calórica y la pérdida de peso son esenciales en el paciente diabético obeso. El manejo adecuado de la dieta por sí solo puede ser efectivo para controlar la glucosa en sangre y los síntomas de hiperglucemia. También se debe enfatizar la importancia de la actividad física regular cuando sea apropiado. Si este programa de tratamiento no logra un control glucémico adecuado, se debe considerar el uso de Glyset. El uso de Glyset debe ser visto por el médico y el paciente como un tratamiento además de la dieta y no como un sustituto de la dieta o como un mecanismo conveniente para evitar la restricción dietética.
parte superior
Contraindicaciones
Las tabletas GLYSET están contraindicadas en pacientes con:
- Cetoacidosis diabética
- Enfermedad inflamatoria intestinal, ulceración colónica u obstrucción intestinal parcial, y en pacientes predispuestos a la obstrucción intestinal.
- Enfermedades intestinales crónicas asociadas con trastornos marcados de digestión o absorción, o con afecciones que pueden deteriorarse como resultado del aumento de la formación de gases en el intestino.
- Hipersensibilidad a la droga o cualquiera de sus componentes.
parte superior
Precauciones
General
Hipoglucemia
Debido a su mecanismo de acción, GLYSET cuando se administra solo no debe causar hipoglucemia en ayunas o postprandial. Los agentes de sulfonilurea pueden causar hipoglucemia. Debido a que las tabletas GLYSET administradas en combinación con una sulfonilurea causarán una disminución adicional de la glucosa en sangre, puede aumentar el potencial hipoglucémico de la sulfonilurea, aunque esto no se observó en clínica juicios. La glucosa oral (dextrosa), cuya absorción no se retrasa con GLYSET, debe usarse en lugar de sacarosa (azúcar de caña) en el tratamiento de la hipoglucemia leve a moderada. La sacarosa, cuya hidrólisis a glucosa y fructosa es inhibida por GLYSET, no es adecuada para la corrección rápida de la hipoglucemia. La hipoglucemia severa puede requerir el uso de una infusión intravenosa de glucosa o una inyección de glucagón.
Pérdida de control de la glucosa en sangre
Cuando los pacientes diabéticos están expuestos al estrés, como fiebre, trauma, infección o cirugía, puede producirse una pérdida temporal de control de la glucosa en sangre. En esos momentos, la terapia de insulina temporal puede ser necesaria.
Insuficiencia renal
Las concentraciones plasmáticas de GLYSET en voluntarios con insuficiencia renal aumentaron proporcionalmente en relación con el grado de disfunción renal. No se han realizado ensayos clínicos a largo plazo en pacientes diabéticos con disfunción renal significativa (creatinina sérica> 2.0 mg / dL). Por lo tanto, no se recomienda el tratamiento de estos pacientes con GLYSET.
Información para pacientes
Se debe proporcionar la siguiente información a los pacientes:
- Glyset debe tomarse por vía oral tres veces al día al comienzo (con el primer bocado) de cada comida principal. Es importante seguir las instrucciones dietéticas, un programa de ejercicio regular y pruebas periódicas de orina y / o glucosa en sangre.
- Glyset en sí no causa hipoglucemia, incluso cuando se administra a pacientes en ayunas. Sin embargo, los medicamentos con sulfonilurea y la insulina pueden reducir los niveles de azúcar en la sangre lo suficiente como para causar síntomas o, a veces, hipoglucemia potencialmente mortal. Debido a que Glyset administrado en combinación con una sulfonilurea o insulina causará una disminución adicional del azúcar en la sangre, puede aumentar el potencial hipoglucémico de estos agentes. El riesgo de hipoglucemia, sus síntomas y tratamiento, y las condiciones que predisponen a su desarrollo deben ser bien entendidos por los pacientes y los familiares responsables. Debido a que Glyset previene la descomposición del azúcar de mesa, debe ser una fuente de glucosa (dextrosa, D-glucosa) fácilmente disponible para tratar los síntomas de bajo nivel de azúcar en la sangre cuando se toma Glyset en combinación con una sulfonilurea o insulina.
- Si se producen efectos secundarios con Glyset, generalmente se desarrollan durante las primeras semanas de tratamiento. Con mayor frecuencia son efectos gastrointestinales leves a moderados relacionados con la dosis, como flatulencia, leve heces, diarrea o molestias abdominales, y generalmente disminuyen en frecuencia e intensidad con hora. La interrupción de la droga generalmente resulta en una resolución rápida de estos síntomas gastrointestinales.
Pruebas de laboratorio
La respuesta terapéutica a GLYSET puede controlarse mediante pruebas periódicas de glucosa en sangre. Se recomienda medir los niveles de hemoglobina glucosilada para el monitoreo del control glucémico a largo plazo.
En 12 hombres sanos, los antiácidos administrados concomitantemente no influyeron en la farmacocinética de miglitol.
Interacciones con la drogas
Varios estudios investigaron la posible interacción entre miglitol y gliburida. En seis voluntarios sanos que recibieron una dosis única de 5 mg de gliburida en un fondo de 6 días de tratamiento con miglitol (50 mg 3 veces al día durante 4 días seguido de 100 mg 3 veces al día durante 2 días) o placebo, la media Cmax y los valores de AUC para gliburida fueron 17% y 25% más bajos, respectivamente, cuando se administró gliburida con miglitol. En un estudio en pacientes diabéticos en el que los efectos de agregar miglitol 100 mg 3 veces al día, 7 días o placebo a un régimen de fondo de 3,5 mg de gliburida diariamente se investigaron, el valor medio de AUC para gliburida fue 18% menor en el grupo tratado con miglitol, aunque esta diferencia no fue estadísticamente significativo. Se obtuvo más información sobre una posible interacción con gliburida de uno de los grandes ensayos clínicos de EE. UU. (Estudio 7) en el que los pacientes recibieron dosis de miglitol o placebo sobre un fondo de gliburida 10 mg dos veces al día. En las visitas clínicas de 6 meses y 1 año, los pacientes que tomaron miglitol concomitante 100 mg 3 veces al día mostraron una media de Cmax valores para gliburida que fueron 16% y 8% más bajos, respectivamente, en comparación con los pacientes que tomaron gliburida sola. Sin embargo, estas diferencias no fueron estadisticamente significativas. Por lo tanto, aunque hubo una tendencia hacia menores AUC y Cmax valores de gliburida cuando se administra conjuntamente con Glyset, no se puede hacer una declaración definitiva con respecto a una interacción potencial basada en los tres estudios anteriores.
Se investigó el efecto del miglitol (100 mg 3 veces al día, 7 días) sobre la farmacocinética de una dosis única de 1000 mg de metformina en voluntarios sanos. AUC y C mediosmax los valores de metformina fueron 12% a 13% más bajos cuando los voluntarios recibieron miglitol en comparación con placebo, pero esta diferencia no fue estadísticamente significativa.
En un estudio voluntario saludable, la administración conjunta de 50 mg o 100 mg de miglitol 3 veces al día junto con digoxina redujo las concentraciones plasmáticas promedio de digoxina en un 19% y 28%, respectivamente. Sin embargo, en pacientes diabéticos en tratamiento con digoxina, las concentraciones plasmáticas de digoxina no fueron alteradas por la administración conjunta de miglitol 100 mg 3 veces al día, 14 días.
Otros estudios voluntarios sanos han demostrado que el miglitol puede reducir significativamente la biodisponibilidad de ranitidina y propranolol en un 60% y 40%, respectivamente. No se observó ningún efecto de miglitol sobre la farmacocinética o farmacodinámica de warfarina o nifedipina.
Adsorbentes intestinales (por ejemplo, carbón vegetal) y preparaciones de enzimas digestivas que contienen las enzimas que se dividen en carbohidratos (por ejemplo, amilasa, pancreatina) pueden reducir el efecto de Glyset y no deben ser tomado concomitantemente
En 12 hombres sanos, los antiácidos administrados concomitantemente no influyeron en la farmacocinética de miglitol.
Carcinogénesis, mutagénesis y deterioro de la fertilidad.
Se administró miglitol a ratones por vía dietética a dosis tan altas como aproximadamente 500 mg / kg. peso corporal (correspondiente a más de 5 veces la exposición en humanos basada en AUC) durante 21 meses. En un estudio de dos años en ratas, se administró miglitol en la dieta a exposiciones comparables a las exposiciones humanas máximas basadas en AUC. No hubo evidencia de carcinogenicidad como resultado del tratamiento dietético con miglitol.
In vitro, se encontró que el miglitol no era mutagénico en el ensayo de mutagénesis bacteriana (Ames) y el ensayo de mutación directa eucariota (CHO / HGPRT). Miglitol no tuvo ningún efecto clastogénico in vivo en la prueba de micronúcleos de ratón. No se detectaron mutaciones hereditarias en el ensayo letal dominante.
Un estudio combinado de fertilidad masculina y femenina realizado en ratas Wistar tratadas por vía oral con miglitol a niveles de dosis de 300 mg / kg de peso corporal (aproximadamente 8 veces la exposición humana máxima basada en el área de superficie corporal) no produjo ningún efecto negativo en el rendimiento o la capacidad reproductiva Reproducir. Además, la supervivencia, el crecimiento, el desarrollo y la fertilidad de la descendencia no se vieron comprometidos.
El embarazo
Efectos teratogénicos
Embarazo Categoría B
No se ha establecido la seguridad de GLYSET en mujeres embarazadas. Se han realizado estudios de toxicología del desarrollo en ratas a dosis de 50, 150 y 450 mg / kg, correspondientes a niveles de aproximadamente 1.5, 4 y 12 veces la exposición humana máxima recomendada en función de la superficie corporal zona. En conejos, se examinaron dosis de 10, 45 y 200 mg / kg correspondientes a niveles de aproximadamente 0,5, 3 y 10 veces la exposición humana. Estos estudios no revelaron evidencia de malformaciones fetales atribuibles al miglitol. Las dosis de miglitol hasta 4 y 3 veces la dosis humana (basada en el área de superficie corporal), para ratas y conejos, respectivamente, no revelaron evidencia de fertilidad deteriorada o daño al feto. Las dosis más altas probadas en estos estudios, 450 mg / kg en la rata y 200 mg / kg en el conejo promovieron la toxicidad materna y / o fetal. La fetotoxicidad se indicó mediante una reducción leve pero significativa en el peso fetal en el estudio de ratas y una ligera reducción en peso fetal, osificación tardía del esqueleto fetal y aumento en el porcentaje de fetos no viables en el conejo estudiar. En el estudio peri-postnatal en ratas, el NOAEL (Nivel de efecto adverso no observado) fue de 100 mg / kg (correspondiente a aproximadamente cuatro veces la exposición a los humanos, según el área de superficie corporal). Se observó un aumento en la progenie de nacidos muertos a la dosis alta (300 mg / kg) en la rata peri-postnatal estudio, pero no a la dosis alta (450 mg / kg) en el segmento de entrega de la toxicidad para el desarrollo de la rata estudiar. De lo contrario, no hubo efectos adversos sobre la supervivencia, el crecimiento, el desarrollo, el comportamiento o la fertilidad, ni en la toxicidad del desarrollo de ratas ni en los estudios peri-postnatales. Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Madres lactantes
Se ha demostrado que el miglitol se excreta en la leche humana en un grado muy pequeño. La excreción total en la leche representó el 0.02% de una dosis materna de 100 mg. La exposición estimada a un lactante es aproximadamente el 0,4% de la dosis materna. Aunque los niveles de miglitol alcanzados en la leche humana son extremadamente bajos, se recomienda que GLYSET no se administre a una mujer lactante.
Uso pediátrico
No se ha establecido la seguridad y eficacia de GLYSET en pacientes pediátricos.
Uso geriátrico
Del número total de sujetos en estudios clínicos de GLYSET en los Estados Unidos, los pacientes válidos para los análisis de seguridad incluyeron 24% sobre 65 y 3% sobre 75. No se observaron diferencias generales en seguridad y efectividad entre estos sujetos y los sujetos más jóvenes. La farmacocinética de miglitol se estudió en hombres mayores y jóvenes (n = 8 por grupo). A la dosis de 100 mg 3 veces al día durante 3 días, no se encontraron diferencias entre los dos grupos.
parte superior
Reacciones adversas
Gastrointestinal
Los síntomas gastrointestinales son las reacciones más comunes a las tabletas GLYSET. En ensayos controlados con placebo en EE. UU., La incidencia de dolor abdominal, diarrea y flatulencia fue de 11.7%, 28.7% y 41.5% respectivamente en 962 pacientes tratados con GLYSET 25-100 mg 3 veces al día, mientras que las incidencias correspondientes fueron 4.7%, 10.0% y 12.0% en 603 tratados con placebo pacientes La incidencia de diarrea y dolor abdominal tendió a disminuir considerablemente con el tratamiento continuo.
Dermatológica
Se informó erupción cutánea en el 4,3% de los pacientes tratados con GLYSET en comparación con el 2,4% de los pacientes tratados con placebo. Las erupciones fueron generalmente transitorias y la mayoría fueron evaluadas como no relacionadas con GLYSET por los investigadores médicos.
Hallazgos anormales de laboratorio
El hierro sérico bajo se produjo con mayor frecuencia en pacientes tratados con GLYSET (9,2%) que en pacientes tratados con placebo (4,2%) pero no persisten en la mayoría de los casos y no se asociaron con reducciones en la hemoglobina o cambios en otros índices hematológicos.
parte superior
Sobredosis
A diferencia de las sulfonilureas o la insulina, una sobredosis de GLYSET Tabletas no provocará hipoglucemia. Una sobredosis puede provocar aumentos transitorios de flatulencia, diarrea y molestias abdominales. Debido a la falta de efectos extra intestinales observados con GLYSET, no se esperan reacciones sistémicas graves en caso de sobredosis.
parte superior
Dosificación y administración
No existe un régimen de dosificación fijo para el tratamiento de la diabetes mellitus con GLYSET Tablets o cualquier otro agente farmacológico. La dosificación de GLYSET debe individualizarse en función de la eficacia y la tolerancia, sin exceder la dosis máxima recomendada de 100 mg 3 veces al día. GLYSET debe tomarse tres veces al día al comienzo (con el primer bocado) de cada comida principal. GLYSET debe iniciarse con 25 mg, y la dosis aumentará gradualmente como se describe a continuación, ambos para reducir efectos adversos gastrointestinales y para permitir la identificación de la dosis mínima requerida para un control glucémico adecuado del paciente
Durante el inicio del tratamiento y la titulación de la dosis (ver más abajo), se puede tomar glucosa plasmática posprandial de una hora se utiliza para determinar la respuesta terapéutica a GLYSET e identificar la dosis mínima efectiva para paciente. Posteriormente, la hemoglobina glicosilada debe medirse a intervalos de aproximadamente tres meses. El objetivo terapéutico debe ser disminuir tanto la glucosa plasmática posprandial como los niveles de hemoglobina glicosilada a la normalidad. o casi normal usando la dosis efectiva más baja de GLYSET, ya sea como monoterapia o en combinación con una sulfonilurea.
Dosis inicial
La dosis inicial recomendada de GLYSET es de 25 mg, administrada por vía oral tres veces al día al comienzo (con el primer bocado) de cada comida principal. Sin embargo, algunos pacientes pueden beneficiarse comenzando con 25 mg una vez al día para minimizar los efectos adversos gastrointestinales y aumentando gradualmente la frecuencia de administración a 3 veces al día.
Dosis de mantenimiento
La dosis de mantenimiento habitual de GLYSET es de 50 mg 3 veces al día, aunque algunos pacientes pueden beneficiarse al aumentar la dosis a 100 mg 3 veces al día. Para permitir la adaptación a los posibles efectos adversos gastrointestinales, se recomienda que la terapia con GLYSET sea iniciado a una dosis de 25 mg 3 veces al día, la dosis efectiva más baja, y luego gradualmente titulada hacia arriba para permitir adaptación. Después de 4 a 8 semanas del régimen de 25 mg 3 veces al día, la dosis debe aumentarse a 50 mg 3 veces al día durante aproximadamente tres meses, después de lo cual se debe medir el nivel de hemoglobina glicosilada para evaluar la terapéutica respuesta. Si, en ese momento, el nivel de hemoglobina glicosilada no es satisfactorio, la dosis puede aumentarse aún más a 100 mg 3 veces al día, la dosis máxima recomendada. Los datos agrupados de estudios controlados sugieren una respuesta a la dosis tanto para HbA1c como para glucosa en plasma posprandial de una hora en todo el rango de dosis recomendado. Sin embargo, ningún estudio individual ha examinado el efecto sobre el control glucémico de valorar las dosis de los pacientes hacia arriba dentro del mismo estudio. Si no se observa una reducción adicional en los niveles de glucosa posprandial o hemoglobina glicosilada con la titulación a 100 mg 3 veces al día, se debe considerar reducir la dosis. Una vez que se establece una dosis efectiva y tolerada, debe mantenerse.
Dosis máxima
La dosis máxima recomendada de GLYSET es de 100 mg 3 veces al día. En un ensayo clínico, 200 mg 3 veces al día dieron un control glucémico mejorado adicional pero aumentaron la incidencia de los síntomas gastrointestinales descritos anteriormente.
Pacientes que reciben sulfonilureas
Los agentes de sulfonilurea pueden causar hipoglucemia. No hubo una mayor incidencia de hipoglucemia en pacientes que tomaron GLYSET en combinación con sulfonilurea agentes en comparación con la incidencia de hipoglucemia en pacientes que reciben sulfonilureas solas en cualquier clínica juicio.
Sin embargo, GLYSET administrado en combinación con una sulfonilurea causará una disminución adicional de la glucosa en sangre y puede aumentar el riesgo de hipoglucemia debido a los efectos aditivos de los dos agentes. Si se produce hipoglucemia, se deben hacer los ajustes apropiados en la dosis de estos agentes.
parte superior
Cómo se suministra
Las tabletas GLYSET están disponibles en tabletas recubiertas con película, redondas, blancas, de 25 mg, 50 mg y 100 mg. Las tabletas están grabadas con la palabra "GLYSET" en un lado y la fuerza en el otro lado, como se indica a continuación.
| Fuerza | NDC | Identificación de tableta | |
| Frente | atrás | ||
| Botellas de 100: | |||
| 25 mg | 0009-5012-01 | GLYSET | 25 |
| 50 mg | 0009-5013-01 | GLYSET | 50 |
| 100 mg | 0009-5014-01 | GLYSET | 100 |
Almacenar a 25 ° C (77 ° F); excursiones permitidas a 15 ° -30 ° C (59 ° -86 ° F) [consulte Temperatura ambiente controlada de la USP].
Solo Rx

Fabricado por:
Bayer HealthCare AG
Leverkusen, Alemania
Glyset es una marca registrada de Bayer HealthCare Pharmaceuticals Inc utilizada bajo licencia.
LAB-0167-6.0
última actualización 05/2008
Glifo, miglitol, información del paciente (en inglés simple)
Información detallada sobre signos, síntomas, causas, tratamientos de diabetes
La información de esta monografía no pretende abarcar todos los usos, instrucciones, precauciones, interacciones farmacológicas o efectos adversos posibles. Esta información es generalizada y no pretende ser un consejo médico específico. Si tiene preguntas sobre los medicamentos que está tomando o desea obtener más información, consulte con su médico, farmacéutico o enfermero.
de regreso: Ver todos los medicamentos para la diabetes



