Levemir para el tratamiento de la diabetes
Nombre de la marca: Levemir
Nombre genérico: Insulina Detemir
Forma de dosificación: inyección
Contenido:
Descripción
Farmacología Clínica
Estudios clínicos
Indicaciones y uso
Contraindicaciones
Advertencias
Precauciones
Reacciones adversas
Sobredosis
Dosificación y administración
Cómo suministrado
Levemir, insulina detemir (origen de ADNr), información del paciente (en inglés simple)
Descripción
Levemir® (inyección de insulina detemir [origen de ADNr]) es una solución estéril de insulina detemir para usar como inyección. Insulin detemir es un análogo de insulina basal de acción prolongada, con una duración de acción de hasta 24 horas, producido por un proceso que incluye la expresión de ADN recombinante en Saccharomyces cerevisiae seguido de químicos modificación.
La insulina detemir difiere de la insulina humana en que se ha omitido el aminoácido treonina en la posición B30 y se ha unido una cadena de ácido graso C14 al aminoácido B29. La insulina detemir tiene una fórmula molecular de C267H402O76N64S6 y un peso molecular de 5916.9. Tiene la siguiente estructura:

Levemir es una solución estéril clara, incolora, acuosa y neutra. Cada mililitro de Levemir contiene 100 U (14,2 mg / ml) de insulina detemir. Cada mililitro de Levemir 10 mL Vial contiene los ingredientes inactivos 65.4 mcg zinc, 2.06 mg m-cresol, 30.0 mg manitol, 1,80 mg de fenol, 0,89 mg de dihidrato de fosfato disódico, 1,17 mg de cloruro de sodio y agua para inyección. Cada mililitro de cartucho PenFill® de 3 ml de Levemir, FlexPen® e InnoLet® contiene los ingredientes inactivos 65,4 mcg de zinc, 2,06 mg m-cresol, 16.0 mg de glicerol, 1.80 mg de fenol, 0.89 mg de dihidrato de fosfato disódico, 1.17 mg de cloruro de sodio y agua para inyección. Se puede agregar ácido clorhídrico y / o hidróxido de sodio para ajustar el pH. Levemir tiene un pH de aproximadamente 7.4.
parte superior
Farmacología Clínica
Mecanismo de acción
La actividad principal de la insulina detemir es la regulación del metabolismo de la glucosa. Las insulinas, incluida la insulina detemir, ejercen su acción específica mediante la unión a los receptores de insulina.
La insulina unida al receptor reduce la glucosa en sangre al facilitar la absorción celular de glucosa en el músculo esquelético y la grasa e inhibiendo la producción de glucosa desde el hígado. La insulina inhibe la lipólisis en el adipocito, inhibe la proteólisis y mejora la síntesis de proteínas.
Farmacodinámica
La insulina detemir es un análogo de insulina humana basal soluble de acción prolongada con un perfil de acción relativamente plano. La duración media de acción de la insulina detemir osciló entre 5,7 horas con la dosis más baja y 23,2 horas con la dosis más alta (período de muestreo de 24 horas).
La acción prolongada de Levemir está mediada por la lenta absorción sistémica de insulina detemir. moléculas del sitio de inyección debido a una fuerte autoasociación de las moléculas del fármaco y la albúmina Unión. La insulina detemir se distribuye más lentamente a los tejidos diana periféricos ya que la insulina detemir en el torrente sanguíneo está altamente unida a la albúmina.
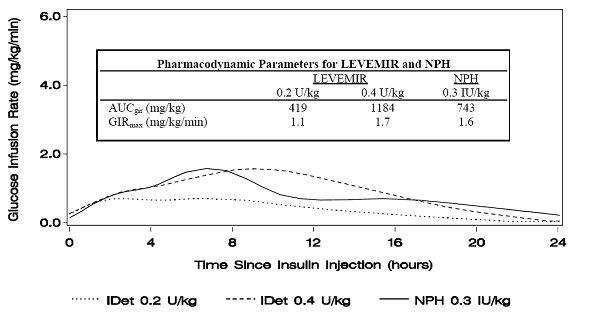
La Figura 1 muestra los resultados de la tasa de infusión de glucosa de un estudio de pinza de glucosa en pacientes con diabetes tipo 1.
Figura 1: Perfiles de actividad en pacientes con diabetes tipo 1 en un estudio de pinza de glucosa de 24 horas
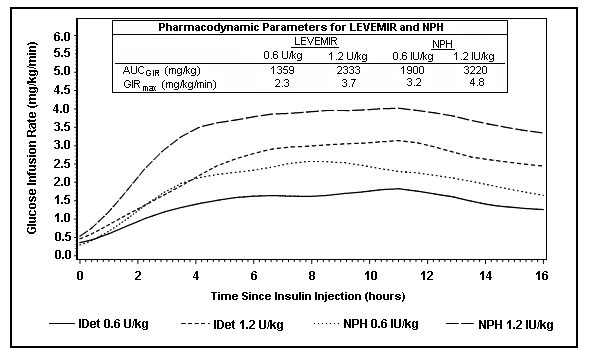
La Figura 2 muestra los resultados de la tasa de infusión de glucosa de un estudio de fijación de glucosa de 16 horas en pacientes con diabetes tipo 2. El estudio de la pinza se terminó a las 16 horas según el protocolo.
Figura 2: Perfiles de actividad en pacientes con diabetes tipo 2 en un estudio de pinza de glucosa de 16 horas
Para dosis en el intervalo de 0.2 a 0.4 U / kg, Levemir ejerce más del 50% de su efecto máximo de 3 a 4 horas hasta aproximadamente 14 horas después de la administración de la dosis.
En un estudio de pinza de glucosa, el efecto glucodinámico general (AUCGIR 0-24 h) [mg / kg ± DE (CV) medio] de cuatro por separado Las inyecciones subcutáneas en el muslo fueron 1702.6 ± 489 mg / kg (29%) en el grupo de Levemir y 1922.8 ± 765 mg / kg (40%) para NPH La importancia clínica de esta diferencia no se ha establecido.
Farmacocinética
Absorción
Después de la inyección subcutánea de insulina detemir en sujetos sanos y en pacientes con diabetes, insulina detemir las concentraciones séricas indicaron una absorción más lenta y prolongada durante 24 horas en comparación con NPH humano insulina.
La concentración sérica máxima (Cmáx) se alcanza entre 6 y 8 horas después de la administración.
La biodisponibilidad absoluta de insulina detemir es aproximadamente del 60%.
Distribución y Eliminación
Más del 98% de insulina detemir en el torrente sanguíneo está unida a la albúmina. Levemir tiene un pequeño volumen aparente de distribución de aproximadamente 0.1 L / kg. Levemir, después de la administración subcutánea, tiene una vida media terminal de 5 a 7 horas, dependiendo de la dosis.
Poblaciones Especiales
Niños y adolescentes: se investigaron las propiedades farmacocinéticas de Levemir en niños (6 a 12 años) y adolescentes (13 a 17 años) y adultos con diabetes tipo 1. Similar a la insulina humana NPH, se observó un área plasmática bajo la curva (AUC) y una Cmáx ligeramente más altas en niños en un 10% y un 24%, respectivamente, en comparación con adolescentes y adultos. No hubo diferencias en la farmacocinética entre adolescentes y adultos.
Geriatría: en un ensayo clínico que investiga las diferencias en la farmacocinética de una dosis subcutánea única de Levemir en jóvenes (25 a 35 años) versus sujetos de edad avanzada (â ‰ ¥ 68 años) sujetos sanos, se encontraron niveles más altos de AUC de insulina (hasta 35%) en sujetos de edad avanzada debido a una reducción despeje. Al igual que con otras preparaciones de insulina, Levemir siempre debe valorarse de acuerdo con los requisitos individuales.
Sexo: en los ensayos clínicos controlados, no se observa una diferencia clínicamente relevante entre los géneros en los parámetros farmacocinéticos basados en análisis de subgrupos.
Raza: en dos ensayos en sujetos sanos japoneses y caucásicos, no se observaron diferencias clínicamente relevantes en los parámetros farmacocinéticos. La farmacocinética y la farmacodinámica de Levemir se investigaron en un ensayo con abrazadera que comparó a pacientes con diabetes tipo 2 de origen caucásico, afroamericano y latino. Las relaciones dosis-respuesta fueron comparables para Levemir en estas tres poblaciones.
Insuficiencia renal: las personas con insuficiencia renal no mostraron diferencias en los parámetros farmacocinéticos en comparación con los voluntarios sanos. Sin embargo, los informes de la literatura han demostrado que el aclaramiento de insulina humana disminuye en pacientes con insuficiencia renal. La monitorización cuidadosa de la glucosa y los ajustes de dosis de insulina, incluido Levemir, pueden ser necesarios en pacientes con disfunción renal (ver PRECAUCIONES, Insuficiencia renal).
Insuficiencia hepática: se observó que las personas con disfunción hepática grave, sin diabetes, tenían AUC más bajos en comparación con los voluntarios sanos. La monitorización cuidadosa de la glucosa y los ajustes de dosis de insulina, incluido Levemir, pueden ser necesarios en pacientes con disfunción hepática (ver PRECAUCIONES, Deterioro hepático).
Embarazo: no se ha estudiado el efecto del embarazo sobre la farmacocinética y farmacodinámica de Levemir (ver PRECAUCIONES, El embarazo ).
Tabaquismo: no se han estudiado los efectos del tabaquismo sobre la farmacocinética y farmacodinámica de Levemir.
parte superior
Estudios clínicos
La eficacia y seguridad de Levemir administrado una vez al día a la hora de acostarse o dos veces al día (antes del desayuno y antes de acostarse, antes del desayuno y con la cena, o en intervalos de 12 horas) se comparó con la de insulina humana NPH una vez al día o dos veces al día o insulina glargina una vez al día en estudios paralelos aleatorios no cegados de 6004 pacientes con diabetes (3724 con tipo 1 y 2280 con tipo 2). En general, los pacientes tratados con Levemir alcanzaron niveles de control glucémico similares a los tratados con insulina humana NPH o insulina glargina, medida por la hemoglobina glucosilada (HbA1c).
Diabetes tipo 1 - Adulto
En un estudio clínico no cegado (Estudio A, n = 409), los pacientes adultos con diabetes tipo 1 fueron asignados al azar a tratamiento con Levemir a intervalos de 12 horas, Levemir mañana y hora de acostarse o NPH insulina humana mañana y hora de acostarse. También se administró insulina aspart antes de cada comida. A las 16 semanas de tratamiento, los pacientes tratados con Levemir combinados tuvieron reducciones similares de HbA1c y glucosa en plasma en ayunas (FPG) en comparación con los pacientes tratados con NPH (Tabla 1). Las diferencias en el momento de la administración de Levemir (o la dosificación flexible) no tuvieron efecto sobre HbA1c, FPG, peso corporal o riesgo de tener episodios de hipoglucemia.
El control glucémico global logrado con Levemir se comparó con el logrado con insulina glargina en un estudio clínico aleatorizado, no cegado, (Estudio B, n = 320) en el que los pacientes con diabetes tipo 1 fueron tratados durante 26 semanas con Levemir dos veces al día (mañana y hora de acostarse) o insulina una vez al día (hora de acostarse) glargina Se administró insulina aspart antes de cada comida. Los pacientes tratados con Levemir tuvieron una disminución en la HbA1c similar a la de los pacientes tratados con insulina glargina.
En un estudio clínico aleatorizado y controlado (Estudio C, n = 749), los pacientes con diabetes tipo 1 fueron tratados con insulina humana Levemir o NPH una vez al día (antes de acostarse), ambas en combinación con insulina soluble humana antes de cada comida 6 meses. La insulina humana Levemir y NPH tuvo un efecto similar sobre la HbA1c.
Tabla 1: Eficacia y dosis de insulina en la diabetes mellitus tipo 1 - Adulto
| Estudio A | ||
| Duración del tratamiento | 16 semanas | |
| Tratamiento en combinación con | NovoLog® (insulina aspart) | |
| Levemir | NPH | |
| Número de sujetos tratados | 276 | 133 |
| HbA1c (%) | ||
| Base | 8.64 | 8.51 |
| Media ajustada al final del estudio | 7.76 | 7.94 |
| Cambio medio desde el inicio | -0.82 | -0.60 |
| Glucosa en plasma en ayunas (mg / dL) | ||
| Media ajustada al final del estudio | 168 | 202 |
| Cambio medio desde el inicio | -42.48 | -10.80 |
| Dosis diaria de insulina basal (U / kg) | ||
| Prestudy mean | 0.36 | 0.39 |
| Fin del estudio medio | 0.49 | 0.45 |
| Dosis diaria de insulina en bolo (U / kg) | ||
| Prestudy mean | 0.40 | 0.40 |
| Fin del estudio medio | 0.38 | 0.38 |
Los valores de referencia se incluyeron como covariables en un análisis ANCOVA. |
Diabetes tipo 1: pediátrica
En un estudio clínico controlado, aleatorizado y no cegado (Estudio D, n = 347), los pacientes pediátricos (rango de edad de 6 a 17) con diabetes tipo 1 fueron tratados durante 26 semanas con un régimen de insulina en bolo basal. Levemir y la insulina humana NPH se administraron una o dos veces al día (hora de acostarse o mañana y hora de acostarse) de acuerdo con el régimen de dosis previa al juicio. Se administró insulina aspart en bolo antes de cada comida. Los pacientes tratados con Levemir tuvieron una disminución de HbA1c similar a la de la insulina humana NPH.
Tabla 2: Eficacia y dosis de insulina en la diabetes mellitus tipo 1 - pediátrica
| Estudio d | ||
| Duración del tratamiento | 26 semanas | |
| Tratamiento en combinación con | NovoLog® (insulina aspart) | |
| Levemir | NPH | |
| Número de sujetos tratados | 232 | 115 |
| HbA1c (%) | ||
| Base | 8.75 | 8.77 |
| Media ajustada al final del estudio | 8.02 | 7.93 |
| Cambio medio desde el inicio | -0.72 | -0.80 |
| Glucosa en plasma en ayunas (mg / dL) | ||
| Media ajustada al final del estudio | 151.92 | 172.44 |
| Cambio medio desde el inicio | -45.00 | -19.98 |
| Dosis diaria de insulina basal (U / kg) | ||
| Prestudy mean | 0.48 | 0.49 |
| Fin del estudio medio | 0.67 | 0.64 |
| Dosis diaria de insulina en bolo (U / kg) | ||
| Prestudy mean | 0.52 | 0.47 |
| Fin del estudio medio | 0.52 | 0.51 |
Diabetes tipo 2 - Adulto
En un estudio clínico aleatorizado, no cegado, de 24 semanas (Estudio E, n = 476), Levemir administrado dos veces al día (antes del desayuno y la noche) se comparó con un régimen similar de NPH insulina humana como parte de un régimen de terapia combinada con uno o dos de los siguientes agentes antidiabéticos orales (metformina, secretagogo de insulina o α-glucosidasa inhibidor) Levemir y NPH redujeron de manera similar la HbA1c desde el inicio (Tabla 3).
Tabla 3: Eficacia y dosis de insulina en la diabetes mellitus tipo 2
| Estudio E | ||
| Duración del tratamiento | 24 semanas | |
| Tratamiento en combinación con | OAD | |
| Levemir | NPH | |
| Número de sujetos tratados | 237 | 239 |
| HbA1c (%) | ||
| Base | 8.61 | 8.51 |
| Media ajustada al final del estudio | 6.58 | 6.46 |
| Cambio medio desde el inicio | -1.84 | -1.90 |
| Proporción de lograr HbA1c ≤ 7% | 70% | 74% |
| Glucosa en plasma en ayunas (mg / dL) | ||
| Media ajustada al final del estudio | 119.16 | 113.40 |
| Cambio medio desde el inicio | -75.96 | -74.34 |
| Dosis diaria de insulina (U / kg) | ||
| Fin del estudio medio | 0.77 | 0.52 |
En un estudio clínico aleatorizado, no cegado, de 22 semanas (Estudio F, n = 395) en adultos con diabetes tipo 2, Levemir y NPH se administraron insulina humana una o dos veces al día como parte de un régimen de bolo basal. Según lo medido por HbA1c o FPG, Levemir tenía una eficacia similar a la insulina humana NPH.
parte superior
Indicaciones y uso
Levemir está indicado para administración subcutánea una o dos veces al día para el tratamiento de pacientes adultos y pediátricos con tipo 1 diabetes mellitus o pacientes adultos con diabetes mellitus tipo 2 que requieren insulina basal (de acción prolongada) para el control de hiperglucemia
parte superior
Contraindicaciones
Levemir está contraindicado en pacientes hipersensibles a la insulina detemir o uno de sus excipientes.
parte superior
Advertencias
La hipoglucemia es el efecto adverso más común de la terapia con insulina, incluido Levemir. Como con todas las insulinas, el momento de la hipoglucemia puede diferir entre varias formulaciones de insulina.
La monitorización de glucosa se recomienda para todos los pacientes con diabetes.
Levemir no debe usarse en bombas de infusión de insulina.
Cualquier cambio en la dosis de insulina debe hacerse con precaución y solo bajo supervisión médica. Cambios en la intensidad de la insulina, el momento de la dosificación, el fabricante, el tipo (por ejemplo, regular, NPH o análogos de insulina), especie (animal, humano), o método de fabricación (ADNr versus insulina de origen animal) puede resultar en la necesidad de un cambio en Dosis.
Es posible que deba ajustarse el tratamiento antidiabético oral concomitante.
parte superior
Precauciones
General
La dosificación inadecuada o la interrupción del tratamiento pueden conducir a hiperglucemia y, en pacientes con diabetes tipo 1, cetoacidosis diabética. Los primeros síntomas de hiperglucemia generalmente ocurren gradualmente durante un período de horas o días. Incluyen náuseas, vómitos, somnolencia, piel seca y enrojecida, boca seca, aumento de la micción, sed y pérdida de apetito, así como el aliento con acetona. Los eventos hiperglucémicos no tratados son potencialmente fatales.
Levemir no está destinado a la administración intravenosa o intramuscular. La duración prolongada de la actividad de la insulina detemir depende de la inyección en el tejido subcutáneo. La administración intravenosa de la dosis subcutánea habitual puede provocar hipoglucemia grave. La absorción después de la administración intramuscular es más rápida y más extensa que la absorción después de la administración subcutánea.
Levemir no debe diluirse ni mezclarse con ninguna otra preparación de insulina (ver PRECAUCIONES, Mezcla de Insulinas).
La insulina puede causar retención de sodio y edema, particularmente si el control metabólico previamente pobre mejora con la terapia intensiva de insulina.
La lipodistrofia y la hipersensibilidad se encuentran entre los posibles efectos adversos clínicos asociados con el uso de todas las insulinas.
Al igual que con todas las preparaciones de insulina, el curso temporal de la acción de Levemir puede variar en diferentes individuos o en diferentes tiempos en el mismo individuo y depende del sitio de inyección, suministro de sangre, temperatura y físico actividad.
Puede ser necesario ajustar la dosis de cualquier insulina si los pacientes cambian su actividad física o su plan de comidas habitual.
Hipoglucemia
Como con todas las preparaciones de insulina, las reacciones hipoglucémicas pueden estar asociadas con la administración de Levemir. La hipoglucemia es el efecto adverso más común de las insulinas. Los síntomas de advertencia temprana de hipoglucemia pueden ser diferentes o menos pronunciados bajo ciertas condiciones, como por ejemplo duración de la diabetes, enfermedad del nervio diabético, uso de medicamentos como betabloqueantes o control intensificado de la diabetes (ver PRECAUCIONES, Interacciones con la drogas). Tales situaciones pueden resultar en hipoglucemia severa (y, posiblemente, pérdida de conciencia) antes de que los pacientes estén conscientes de la hipoglucemia.
El tiempo de aparición de hipoglucemia depende del perfil de acción de las insulinas utilizadas y, por lo tanto, puede cambiar cuando se cambia el régimen de tratamiento o el momento de la dosificación. En los pacientes que cambian de otras preparaciones de insulina de acción intermedia o prolongada a Levemir una o dos veces al día, las dosis se pueden prescribir de una unidad a otra; sin embargo, como con todas las preparaciones de insulina, la dosis y el momento de la administración pueden necesitar ajustarse para reducir el riesgo de hipoglucemia (ver DOSIFICACIÓN Y ADMINISTRACIÓN, Cambio a Levemir).
Insuficiencia renal
Al igual que con otras insulinas, es posible que sea necesario ajustar los requisitos de Levemir en pacientes con insuficiencia renal (ver FARMACOLOGÍA CLÍNICA, Farmacocinética).
Deterioro hepático
Al igual que con otras insulinas, es posible que sea necesario ajustar los requisitos de Levemir en pacientes con insuficiencia hepática (ver FARMACOLOGÍA CLÍNICA, Farmacocinética).
Sitio de inyección y reacciones alérgicas
Al igual que con cualquier terapia con insulina, la lipodistrofia puede ocurrir en el sitio de inyección y retrasar la absorción de insulina. Otras reacciones en el sitio de inyección con terapia de insulina pueden incluir enrojecimiento, dolor, picazón, urticaria, hinchazón e inflamación. La rotación continua del sitio de inyección dentro de un área determinada puede ayudar a reducir o prevenir estas reacciones. Las reacciones generalmente se resuelven en unos pocos días a unas pocas semanas. En raras ocasiones, las reacciones en el lugar de la inyección pueden requerir la suspensión de Levemir.
En algunos casos, estas reacciones pueden estar relacionadas con factores distintos de la insulina, como los irritantes en un agente de limpieza de la piel o una técnica de inyección deficiente.
Alergia sistémica: la alergia generalizada a la insulina, que es menos común pero potencialmente más grave, puede causar sarpullido (incluido el prurito) en todo el cuerpo, dificultad para respirar, sibilancias, reducción de la presión arterial, pulso rápido o transpiración. Los casos graves de alergia generalizada, incluida la reacción anafiláctica, pueden ser potencialmente mortales.
Condiciones intercurrentes
Los requisitos de insulina pueden alterarse durante condiciones intercurrentes como enfermedades, trastornos emocionales u otras tensiones.
Información para pacientes
Levemir solo debe usarse si la solución parece transparente e incolora sin partículas visibles (ver DOSIFICACIÓN Y ADMINISTRACIÓN, Preparación y manejo). Se debe informar a los pacientes sobre los posibles riesgos y ventajas de la terapia con Levemir, incluidos los posibles efectos secundarios. Se debe ofrecer a los pacientes educación y asesoramiento continuos sobre las terapias con insulina, la técnica de inyección, el manejo del estilo de vida, el monitoreo regular de la glucosa, las pruebas periódicas de hemoglobina glicosilada, Reconocimiento y manejo de la hipoglucemia y la hiperglucemia, adherencia a la planificación de las comidas, complicaciones de la terapia con insulina, tiempo de dosificación, instrucciones para el uso de dispositivos de inyección y almacenamiento adecuado de insulina. Se debe informar a los pacientes que se necesitan mediciones frecuentes de glucosa en sangre realizadas por el paciente para lograr un control glucémico efectivo y evitar tanto la hiperglucemia como la hipoglucemia. Se debe instruir a los pacientes sobre el manejo de situaciones especiales como condiciones intercurrentes (enfermedad, estrés o trastornos emocionales). trastornos), una dosis de insulina inadecuada u omitida, administración inadvertida de una dosis aumentada de insulina, ingesta inadecuada de alimentos o comidas omitidas Remita a los pacientes a la circular "Información del paciente" de Levemir para obtener información adicional.
Al igual que con todos los pacientes con diabetes, la capacidad de concentración y / o reacción puede verse afectada como resultado de la hipoglucemia o la hiperglucemia.
Se debe aconsejar a las pacientes con diabetes que informen a su profesional de la salud si están embarazadas o si están contemplando un embarazo (ver PRECAUCIONES, El embarazo ).
Pruebas de laboratorio
Al igual que con toda la terapia con insulina, la respuesta terapéutica a Levemir debe controlarse mediante pruebas periódicas de glucosa en sangre. Se recomienda la medición periódica de HbA1c para el control del control glucémico a largo plazo.
Interacciones con la drogas
Varias sustancias afectan el metabolismo de la glucosa y pueden requerir un ajuste de la dosis de insulina y, en particular, una estrecha vigilancia.
Los siguientes son ejemplos de sustancias que pueden reducir el efecto hipoglucemiante de la insulina: corticosteroides, danazol, diuréticos, agentes simpaticomiméticos. (p. ej., epinefrina, albuterol, terbutalina), isoniazida, derivados de fenotiazina, somatropina, hormonas tiroideas, estrógenos, progestágenos (p. ej., por vía oral anticonceptivos).
Los siguientes son ejemplos de sustancias que pueden aumentar el efecto hipoglucemiante de la insulina y la susceptibilidad a la hipoglucemia: antidiabético oral medicamentos, inhibidores de la ECA, disopiramida, fibratos, fluoxetina, inhibidores de la MAO, propoxifeno, salicilatos, análogo de somatostatina (por ejemplo, octreótido) y sulfonamida antibióticos
Los betabloqueantes, la clonidina, las sales de litio y el alcohol pueden potenciar o debilitar el efecto hipoglucemiante de la insulina. La pentamidina puede causar hipoglucemia, que a veces puede ser seguida de hiperglucemia. Además, bajo la influencia de medicamentos simpaticolíticos como los betabloqueantes, la clonidina, la guanetidina y la reserpina, los signos de hipoglucemia pueden estar reducidos o ausentes.
Los resultados de los estudios de unión a proteínas in vitro e in vivo demuestran que no existe interacción clínicamente relevante entre la insulina detemir y los ácidos grasos u otros fármacos unidos a proteínas.
Mezcla de Insulinas
Si Levemir se mezcla con otras preparaciones de insulina, el perfil de acción de uno o ambos componentes individuales puede cambiar. La mezcla de Levemir con insulina aspart, un análogo de insulina de acción rápida, dio como resultado una reducción de aproximadamente el 40% en el AUC (0-2 h) y Cmax para insulina aspart en comparación con inyecciones separadas cuando la proporción de insulina aspart a Levemir fue inferior a 50%.
Levemir NO debe mezclarse ni diluirse con ninguna otra preparación de insulina.
Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios estándar de carcinogenicidad de 2 años en animales. La insulina detemir resultó negativa para el potencial genotóxico en el estudio de mutación inversa in vitro en bacterias, prueba de aberración cromosómica de linfocitos de sangre periférica humana y el ratón in vivo prueba de micronúcleos.
El embarazo
Embarazo Categoría C
Efectos teratogénicos
En un estudio de fertilidad y desarrollo embrionario, se administró insulina detemir a ratas hembras antes del apareamiento, durante el apareamiento y durante el embarazo a dosis de hasta 300 nmol / kg / día (3 veces la dosis humana recomendada, según el área plasmática bajo la curva (AUC) proporción). Las dosis de 150 y 300 nmol / kg / día produjeron cantidades de camadas con anomalías viscerales. Se administraron a conejos dosis de hasta 900 nmol / kg / día (aproximadamente 135 veces la dosis humana recomendada según la proporción de AUC) durante la organogénesis. Se observaron aumentos relacionados con la dosis del fármaco en la incidencia de fetos con anomalías de la vesícula biliar, como vesículas pequeñas, bilobadas, bifurcadas y faltantes de vesícula biliar a una dosis de 900 nmol / kg / día. Los estudios de desarrollo embriofetal en ratas y conejos que incluyeron grupos concurrentes de control de insulina humana indicó que la insulina detemir y la insulina humana tuvieron efectos similares con respecto a la embriotoxicidad y teratogenicidad
Madres lactantes
Se desconoce si Levemir se excreta en cantidades significativas en la leche humana. Por esta razón, se debe tener precaución cuando Levemir se administra a una madre lactante. Los pacientes con diabetes que están en periodo de lactancia pueden requerir ajustes en la dosis de insulina, el plan de comidas o ambos.
Uso pediátrico
En un estudio clínico controlado, las concentraciones de HbA1c y las tasas de hipoglucemia fueron similares entre los pacientes tratados con Levemir y los pacientes tratados con insulina humana NPH.
Uso geriátrico
Del número total de sujetos en estudios clínicos a medio y largo plazo de Levemir, 85 (estudios tipo 1) y 363 (estudios tipo 2) tenían 65 años o más. No se observaron diferencias generales en seguridad o efectividad entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica informada ha No se identificaron diferencias en las respuestas entre los pacientes de edad avanzada y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores. En pacientes de edad avanzada con diabetes, la dosis inicial, los incrementos de dosis y la dosis de mantenimiento deben ser conservadores para evitar reacciones hipoglucémicas. La hipoglucemia puede ser difícil de reconocer en los ancianos.
parte superior
Reacciones adversas
Los eventos adversos comúnmente asociados con la terapia con insulina humana incluyen los siguientes:
Cuerpo entero: reacciones alérgicas (ver PRECAUCIONES, Alergia).
Piel y apéndices: lipodistrofia, prurito, erupción cutánea. Las reacciones leves en el lugar de la inyección ocurrieron con mayor frecuencia con Levemir que con la insulina humana NPH y generalmente se resolvieron en unos pocos días a algunas semanas PRECAUCIONES, Alergia).
Otro:
Hipoglucemia: (ver Advertencias y PRECAUCIONES).
En ensayos de hasta 6 meses de duración en pacientes con diabetes tipo 1 y tipo 2, la incidencia de hipoglucemia grave con Levemir fue comparable a la incidencia con NPH y, como se esperaba, mayor en general en pacientes con diabetes tipo 1 (Tabla 4).
Aumento de peso:
En ensayos de hasta 6 meses de duración en pacientes con diabetes tipo 1 y tipo 2, Levemir se asoció con un aumento de peso algo menor que la NPH (Tabla 4). No se sabe si estas diferencias observadas representan verdaderas diferencias en los efectos de Levemir y la insulina NPH, ya que estos ensayos no fueron cegados y el Los protocolos (p. ej., instrucciones y monitoreo de dieta y ejercicio) no se dirigieron específicamente a la exploración de hipótesis relacionadas con los efectos del peso de los tratamientos. comparado. No se ha establecido la importancia clínica de las diferencias observadas.
Tabla 4: Información de seguridad en estudios clínicos *
| ||||||
| Peso (kg) | Hipoglucemia (eventos / sujeto / mes) | |||||
| Tratamiento | # de sujetos | Base | Fin del tratamiento | Mayor†| MenorC | |
| Tipo 1 | ||||||
| Estudio A | Levemir | N = 276 | 75.0 | 75.1 | 0.045 | 2.184 |
| NPH | N = 133 | 75.7 | 76.4 | 0.035 | 3.063 | |
| Estudio c | Levemir | N = 492 | 76.5 | 76.3 | 0.029 | 2.397 |
| NPH | N = 257 | 76.1 | 76.5 | 0.027 | 2.564 | |
| Estudio D pediátrico | Levemir | N = 232 | N / A | N / A | 0.076 | 2.677 |
| NPH | N = 115 | N / A | N / A | 0.083 | 3.203 | |
| Tipo 2 | ||||||
| Estudio E | Levemir | N = 237 | 82.7 | 83.7 | 0.001 | 0.306 |
| NPH | N = 239 | 82.4 | 85.2 | 0.006 | 0.595 | |
| Estudio F | Levemir | N = 195 | 81.8 | 82.3 | 0.003 | 0.193 |
| NPH | N = 200 | 79.6 | 80.9 | 0.006 | 0.235 |
parte superior
Sobredosis
La hipoglucemia puede ocurrir como resultado de un exceso de insulina en relación con la ingesta de alimentos, el gasto de energía o ambos. Los episodios leves de hipoglucemia generalmente se pueden tratar con glucosa oral. Es posible que se necesiten ajustes en la dosis del medicamento, patrones de comida o ejercicio. Los episodios más graves con coma, convulsiones o deterioro neurológico pueden tratarse con glucagón intramuscular / subcutáneo o glucosa intravenosa concentrada. Después de la aparente recuperación clínica de la hipoglucemia, puede ser necesaria la observación continuada y la ingesta adicional de carbohidratos para evitar la recurrencia de la hipoglucemia.
parte superior
Dosificación y administración
Levemir puede administrarse una o dos veces al día. La dosis de Levemir debe ajustarse de acuerdo con las mediciones de glucosa en sangre. La dosificación de Levemir debe individualizarse según los consejos del médico, de acuerdo con las necesidades del paciente.
- Para los pacientes tratados con Levemir una vez al día, la dosis debe administrarse con la cena o al acostarse.
- Para los pacientes que requieren una dosificación dos veces al día para un control eficaz de la glucosa en sangre, la dosis vespertina puede administrarse con la cena, a la hora de acostarse o 12 horas después de la dosis matutina.
Levemir debe administrarse mediante inyección subcutánea en el muslo, la pared abdominal o la parte superior del brazo. Los sitios de inyección deben rotarse dentro de la misma región. Como con todas las insulinas, la duración de la acción variará de acuerdo con la dosis, el sitio de inyección, el flujo sanguíneo, la temperatura y el nivel de actividad física.
Determinación de dosis para Levemir
- Para pacientes con diabetes tipo 1 o tipo 2 en tratamiento con bolo basal, el cambio de la insulina basal a Levemir se puede hacer de una unidad a otra. La dosis de Levemir debe ajustarse para alcanzar los objetivos glucémicos. En algunos pacientes con diabetes tipo 2, se puede requerir más Levemir que la insulina NPH. En un estudio clínico, la dosis media al final del tratamiento fue de 0,77 U / kg para Levemir y 0,52 UI / kg para la insulina humana NPH (ver Tabla 3).
- Para los pacientes que actualmente reciben solo insulina basal, el cambio de la insulina basal a Levemir se puede hacer de una unidad a otra.
- Para los pacientes que no hayan recibido insulina con diabetes tipo 2 y que no estén controlados adecuadamente con medicamentos antidiabéticos orales, se debe iniciar Levemir a una dosis de 0.1 a 0.2 U / kg una vez al día por la tarde o 10 unidades una o dos veces al día, y la dosis ajustada para lograr la glucemia objetivos.
- Al igual que con todas las insulinas, se recomienda una estrecha monitorización de la glucosa durante la transición y en las semanas iniciales posteriores. Es posible que sea necesario ajustar la dosis y el momento de las insulinas concurrentes de acción corta u otro tratamiento antidiabético concomitante.
Preparación y manejo
Levemir debe inspeccionarse visualmente antes de la administración y solo debe usarse si la solución parece transparente e incolora.
Levemir no debe mezclarse ni diluirse con ninguna otra preparación de insulina.
Después de cada inyección, los pacientes deben retirar la aguja sin volver a taparla y desecharla en un recipiente resistente a los pinchazos. Las jeringas, agujas o lancetas usadas deben colocarse en recipientes "punzantes" (como un biopeligro rojo) recipientes), recipientes de plástico duro (como botellas de detergente) o recipientes metálicos (como un recipiente vacío lata de café). Dichos contenedores deben sellarse y eliminarse adecuadamente.
parte superior
Cómo suministrado
Levemir está disponible en los siguientes tamaños de paquete: cada presentación contiene 100 unidades de insulina detemir por ml (U-100).
| Vial de 10 ml | NDC 0169-3687-12 |
| 3 ml de PenFill® cartuchos * | NDC 0169-3305-11 |
| 3 ml de InnoLet® | NDC 0169-2312-11 |
| 3 ml de FlexPen® | NDC 0169-6439-10 |
* Los cartuchos Levemir PenFill® se usan con dispositivos de administración de insulina compatibles con cartuchos PenFill® Novo Nordisk de 3 ml y agujas desechables NovoFine®.
Última actualización 05/2007
Levemir, insulina detemir (origen de ADNr), información del paciente (en inglés simple)
Información detallada sobre signos, síntomas, causas, tratamientos de diabetes
La información en esta monografía no pretende cubrir todos los usos, instrucciones, precauciones, interacciones de drogas o efectos adversos posibles. Esta información es generalizada y no pretende ser un consejo médico específico. Si tiene preguntas sobre los medicamentos que está tomando o desea obtener más información, consulte con su médico, farmacéutico o enfermero.
de regreso: Ver todos los medicamentos para la diabetes

