Avandia para el tratamiento de la diabetes
Nombre de la marca: AVANDIA
Nombre generico: maleato de rosiglitazona
Contenido:
Indicaciones y uso
Dosificación y administración
Formas de dosificación y concentraciones
Contraindicaciones
Advertencias y precauciones
Reacciones adversas
Interacciones con la drogas
Uso en poblaciones específicas
Sobredosis
Descripción
Farmacología Clínica
Toxicología no clínica
Estudios clínicos
Cómo suministrado
Avandia, maleato de rosiglitazona, información para el paciente (en inglés simple)
ADVERTENCIA
Insuficiencia cardíaca congestiva e isquemia miocárdica
- Las tiazolidinedionas, incluida la rosiglitazona, causan o exacerban la insuficiencia cardíaca congestiva en algunos pacientes [ver ADVERTENCIAS Y PRECAUCIONES]. Después del inicio de AVANDIA, y después de que aumente la dosis, observe a los pacientes cuidadosamente para detectar signos y síntomas de insuficiencia cardíaca (incluyendo aumento de peso excesivo, rápido, disnea y / o edema). Si se desarrollan estos signos y síntomas, la insuficiencia cardíaca debe manejarse de acuerdo con los estándares actuales de atención. Además, se debe considerar la suspensión o la reducción de la dosis de AVANDIA.
- AVANDIA no se recomienda en pacientes con insuficiencia cardíaca sintomática. El inicio de AVANDIA en pacientes con insuficiencia cardíaca establecida de clase III o IV de la NYHA está contraindicado. [Ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES.]
- Un metaanálisis de 42 estudios clínicos (duración media 6 meses; 14,237 pacientes en total), la mayoría de los cuales compararon AVANDIA con placebo, mostraron que AVANDIA se asocia con un mayor riesgo de eventos isquémicos miocárdicos como angina o infarto de miocardio. Otros tres estudios (duración media 41 meses; 14.067 pacientes en total), al comparar AVANDIA con otros agentes antidiabéticos orales o placebo aprobados, no han confirmado ni excluido este riesgo. En su totalidad, los datos disponibles sobre el riesgo de isquemia miocárdica no son concluyentes. [Ver ADVERTENCIAS Y PRECAUCIONES.]
parte superior
Indicaciones y uso
Monoterapia y terapia combinada
AVANDIA está indicado como un complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2.
Limitaciones importantes de uso
- Debido a su mecanismo de acción, AVANDIA es activa solo en presencia de insulina endógena. Por lo tanto, AVANDIA no debe usarse en pacientes con diabetes mellitus tipo 1 o para el tratamiento de la cetoacidosis diabética.
- No se recomienda la administración conjunta de AVANDIA e insulina.
- No se recomienda el uso de AVANDIA con nitratos.
parte superior
Dosificación y administración
El manejo de la terapia antidiabética debe ser individualizado. Todos los pacientes deben comenzar AVANDIA con la dosis más baja recomendada. Los aumentos adicionales en la dosis de AVANDIA deben ir acompañados de un control cuidadoso de los eventos adversos relacionados con la retención de líquidos [ver Advertencia en caja y Advertencias y precauciones].
AVANDIA puede administrarse a una dosis inicial de 4 mg como una dosis diaria única o en 2 dosis divididas. Para pacientes que responden inadecuadamente después de 8 a 12 semanas de tratamiento, según lo determinado por la reducción de la glucosa plasmática en ayunas (FPG), la dosis puede aumentarse a 8 mg diarios en monoterapia o en combinación con metformina, sulfonilurea o sulfonilurea más metformina Las reducciones en los parámetros glucémicos por dosis y régimen se describen en Estudios clínicos. AVANDIA puede tomarse con o sin alimentos.
La dosis diaria total de AVANDIA no debe exceder los 8 mg.
Monoterapia
La dosis inicial habitual de AVANDIA es de 4 mg administrados como una dosis única una vez al día o en dosis divididas dos veces al día. En ensayos clínicos, el régimen de 4 mg dos veces al día resultó en la mayor reducción de FPG y hemoglobina A1c (HbA1c).
Combinación con sulfonilurea o metformina
Cuando se agrega AVANDIA a la terapia existente, la (s) dosis (s) actual (es) del (los) agente (s) pueden continuarse al inicio de la terapia con AVANDIA.
Sulfonilurea: Cuando se usa en combinación con sulfonilurea, la dosis inicial habitual de AVANDIA es de 4 mg administrados como una dosis única una vez al día o en dosis divididas dos veces al día. Si los pacientes reportan hipoglucemia, la dosis de sulfonilurea debe disminuirse.
Metformina: La dosis inicial habitual de AVANDIA en combinación con metformina es de 4 mg administrados como una dosis única una vez al día o en dosis divididas dos veces al día. Es poco probable que la dosis de metformina requiera un ajuste debido a la hipoglucemia durante la terapia de combinación con AVANDIA.
Combinación con sulfonilurea más metformina
La dosis inicial habitual de AVANDIA en combinación con una sulfonilurea más metformina es de 4 mg administrados como una dosis única una vez al día o dosis divididas dos veces al día. Si los pacientes reportan hipoglucemia, la dosis de sulfonilurea debe disminuirse.
Poblaciones específicas de pacientes
Insuficiencia renal: No es necesario ajustar la dosis cuando AVANDIA se usa como monoterapia en pacientes con insuficiencia renal. Dado que la metformina está contraindicada en tales pacientes, la administración concomitante de metformina y AVANDIA también está contraindicada en pacientes con insuficiencia renal.
Deterioro hepático: Las enzimas hepáticas deben medirse antes de iniciar el tratamiento con AVANDIA. La terapia con AVANDIA no debe iniciarse si el paciente presenta evidencia clínica de actividad enfermedad hepática o aumento de los niveles séricos de transaminasas (ALT> 2.5 veces el límite superior de la normalidad al inicio de terapia). Después del inicio de AVANDIA, las enzimas hepáticas deben controlarse periódicamente según el criterio clínico del profesional sanitario. [Ver Advertencias y precauciones y FARMACOLOGÍA CLÍNICA.]
Pediátrico: Los datos son insuficientes para recomendar el uso pediátrico de AVANDIA [ver USO en POBLACIONES ESPECÍFICAS].
parte superior
Formas de dosificación y fortalezas
La tableta TILTAB recubierta con película pentagonal contiene rosiglitazona como maleato de la siguiente manera:
- 2 mg - rosa, grabado con SB en un lado y 2 en el otro
- 4 mg - naranja, grabado con SB en un lado y 4 en el otro
- 8 mg - rojo-marrón, grabado con SB en un lado y 8 en el otro
parte superior
Contraindicaciones
El inicio de AVANDIA en pacientes con insuficiencia cardíaca de clase III o IV establecida por la New York Heart Association (NYHA) está contraindicado [ver ADVERTENCIA EN CAJA].
parte superior
Advertencias y precauciones
Falla cardiaca
AVANDIA, como otras tiazolidinedionas, solo o en combinación con otros agentes antidiabéticos, puede causar retención de líquidos, lo que puede exacerbar o provocar insuficiencia cardíaca. Se debe observar a los pacientes para detectar signos y síntomas de insuficiencia cardíaca. Si se desarrollan estos signos y síntomas, la insuficiencia cardíaca debe manejarse de acuerdo con los estándares actuales de atención. Además, se debe considerar la suspensión o la reducción de la dosis de rosiglitazona [ver ADVERTENCIA EN CAJA].
Los pacientes con insuficiencia cardíaca congestiva (CHF) NYHA Clase I y II tratados con AVANDIA tienen un mayor riesgo de eventos cardiovasculares. Se realizó un estudio ecocardiográfico doble ciego controlado con placebo de 52 semanas en 224 pacientes con tipo 2 diabetes mellitus y CHF NYHA Clase I o II (fracción de eyección â ‰ ¤ 45%) sobre antidiabéticos de fondo y CHF terapia. Un comité independiente realizó una evaluación cegada de eventos relacionados con fluidos (incluyendo insuficiencia cardíaca congestiva) y hospitalizaciones cardiovasculares según criterios predefinidos (adjudicación). Aparte de la adjudicación, los investigadores informaron otros eventos adversos cardiovasculares. Aunque no se observaron diferencias de tratamiento en el cambio desde el inicio de las fracciones de eyección, más Se observaron eventos adversos cardiovasculares después del tratamiento con AVANDIA en comparación con placebo durante el Estudio de 52 semanas. (Ver Tabla 1.)
Tabla 1. Eventos adversos cardiovasculares emergentes en pacientes con insuficiencia cardíaca congestiva (NYHA clase I y II) tratados con AVANDIA o placebo (además del tratamiento antidiabético de fondo y la CHF)
| Eventos | AVANDIA N = 110 n (%) |
Placebo N = 114 n (%) |
| Juzgado | ||
| Muertes cardiovasculares | 5 (5%) | 4 (4%) |
| Empeoramiento de CHF | 7 (6%) | 4 (4%) |
| - con hospitalización nocturna | 5 (5%) | 4 (4%) |
| - sin hospitalización nocturna | 2 (2%) | 0 (0%) |
| Edema nuevo o que empeora | 28 (25%) | 10 (9%) |
| Disnea nueva o que empeora | 29 (26%) | 19 (17%) |
| Aumentos en la medicación CHF | 36 (33%) | 20 (18%) |
| Hospitalización cardiovascular * | 21 (19%) | 15 (13%) |
| Reportado por el investigador, no adjudicado | ||
| Eventos adversos isquémicos | 10 (9%) | 5 (4%) |
| - Infarto de miocardio | 5 (5%) | 2 (2%) |
| - angina | 6 (5%) | 3 (3%) |
| * Incluye hospitalización por cualquier motivo cardiovascular. |
El inicio de AVANDIA en pacientes con insuficiencia cardíaca establecida de clase III o IV de la NYHA está contraindicado. AVANDIA no se recomienda en pacientes con insuficiencia cardíaca sintomática. [Ver ADVERTENCIA EN CAJA.]
Los pacientes con síndromes coronarios agudos no se han estudiado en ensayos clínicos controlados. En vista del potencial de desarrollo de insuficiencia cardíaca en pacientes que tienen un evento coronario agudo, no se inicia AVANDIA. recomendado para pacientes que experimentan un evento coronario agudo, y la interrupción de AVANDIA durante esta fase aguda debe ser considerado.
Los pacientes con estado cardíaco de clase III y IV de la NYHA (con o sin ICC) no se han estudiado en ensayos clínicos controlados. AVANDIA no se recomienda en pacientes con estado cardíaco de clase III y IV de NYHA.
Isquemia miocardica
Metaanálisis de isquemia miocárdica en un grupo de 42 ensayos clínicos
Se realizó un metanálisis retrospectivamente para evaluar los eventos adversos cardiovasculares informados en 42 ensayos clínicos controlados aleatorios, doble ciego (duración media de 6 meses).1
Estos estudios se llevaron a cabo para evaluar la eficacia reductora de la glucosa en la diabetes tipo 2, y la adjudicación prospectiva de eventos cardiovasculares no se había producido en los ensayos. Algunos ensayos fueron controlados con placebo y algunos utilizaron fármacos antidiabéticos orales activos como controles. Los estudios controlados con placebo incluyeron ensayos de monoterapia (monoterapia con AVANDIA versus monoterapia con placebo) y ensayos complementarios (AVANDIA o placebo, agregados a sulfonilurea, metformina o insulina). Los estudios de control activo incluyeron ensayos de monoterapia (monoterapia con AVANDIA versus sulfonilurea o metformina monoterapia) y ensayos complementarios (AVANDIA más sulfonilurea o AVANDIA más metformina, versus sulfonilurea más metformina). Se incluyeron un total de 14,237 pacientes (8,604 en los grupos de tratamiento que contienen AVANDIA, 5,633 en grupos de comparación), con 4.143 años-paciente de exposición a AVANDIA y 2.675 años-paciente de exposición a comparador Los eventos isquémicos miocárdicos incluyeron angina de pecho, angina de pecho agravada, angina inestable, paro cardíaco, dolor torácico, coronario oclusión arterial, disnea, infarto de miocardio, trombosis coronaria, isquemia miocárdica, enfermedad coronaria y arteria coronaria trastorno. En este análisis, un mayor riesgo de isquemia miocárdica con AVANDIA versus comparadores agrupados se observó (2% AVANDIA versus 1.5% comparadores, odds ratio 1.4, 95% intervalo de confianza [IC] 1.1, 1.8). Se observó un mayor riesgo de eventos isquémicos miocárdicos con AVANDIA en los estudios controlados con placebo, pero no en los estudios controlados activos. (Ver Figura 1.)
Se observó un mayor riesgo mayor de eventos isquémicos miocárdicos en estudios donde se agregó AVANDIA a insulina (2.8% para AVANDIA más insulina versus 1.4% para placebo más insulina, [OR 2.1, IC 95% 0.9, 5.1]). Este mayor riesgo refleja una diferencia de 3 eventos por 100 pacientes-año (IC 95% -0,1, 6,3) entre los grupos de tratamiento. [Ver ADVERTENCIAS Y PRECAUCIONES.]
Figura 1. Gráfica de probabilidades de bosque (intervalos de confianza del 95%) para eventos isquémicos miocárdicos en el metanálisis de 42 ensayos clínicos
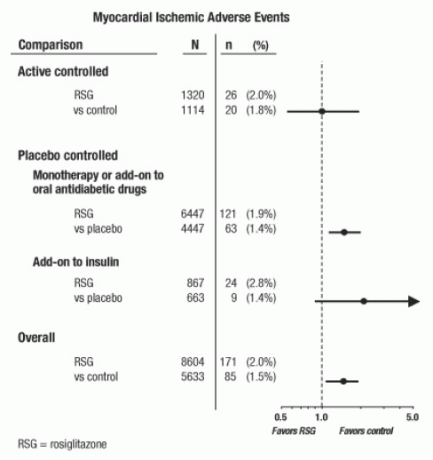
También se observó un mayor riesgo de isquemia miocárdica en pacientes que recibieron AVANDIA y terapia de nitrato de fondo. Para AVANDIA (N = 361) versus control (N = 244) en usuarios de nitrato, la razón de probabilidad fue 2.9 (IC 95% 1.4, 5.9), mientras que para los usuarios que no usan nitrato (alrededor de 14,000 pacientes en total), la razón de probabilidad fue 1.3 (IC 95% 0.9, 1.7). Este aumento del riesgo representa una diferencia de 12 eventos isquémicos miocárdicos por 100 pacientes-año (IC del 95%: 3,3, 21,4). La mayoría de los usuarios de nitrato habían establecido enfermedad coronaria. Entre los pacientes con enfermedad coronaria conocida que no estaban en terapia de nitrato, no se demostró un mayor riesgo de eventos isquémicos de miocardio para AVANDIA versus comparador.
Eventos isquémicos de miocardio en grandes ensayos controlados aleatorios prospectivos a largo plazo de AVANDIA
Los datos de otros 3 ensayos clínicos controlados aleatorizados, prospectivos, aleatorizados y a largo plazo de AVANDIA se evaluaron por separado del metanálisis. Estos 3 ensayos incluyen un total de 14.067 pacientes (grupos de tratamiento que contienen AVANDIA N = 6.311, comparador grupos N = 7,756), con exposición al paciente por año de 21,803 años-paciente para AVANDIA y 25,998 años-paciente para comparador La duración del seguimiento superó los 3 años en cada estudio. ADOPT (A Diabetes Outcomes Progressive Trial) fue un estudio aleatorizado de 4 a 6 años, controlado de forma activa en pacientes recientemente diagnosticados con diabetes tipo 2 sin tratamiento previo farmacológico.
Fue un ensayo de eficacia y seguridad general diseñado para examinar la durabilidad de
AVANDIA como monoterapia (N = 1,456) para el control glucémico en la diabetes tipo 2, con brazos comparadores de monoterapia con sulfonilurea (N = 1,441) y monoterapia con metformina (N = 1,454). DREAM (Evaluación de reducción de la diabetes con rosiglitazona y medicación Ramipril, informe publicado2) fue un 3 a Estudio aleatorizado de 5 años, controlado con placebo en pacientes con intolerancia a la glucosa y / o ayuno deteriorado glucosa. Tenía un diseño factorial 2x2, destinado a evaluar el efecto de AVANDIA, y por separado de ramipril (un inhibidor de la enzima convertidora de angiotensina [IECA]), en la progresión a diabetes manifiesta. En DREAM, 2.635 pacientes estaban en grupos de tratamiento que contenían AVANDIA, y 2.634 estaban en grupos de tratamiento que no contenían AVANDIA. Los resultados intermedios se han publicado 3 para RECORD (Rosiglitazone Evaluado para Resultados Cardíacos y Regulación de la Glucemia en Diabetes), un estudio abierto de resultados cardiovasculares de 6 años en pacientes con diabetes tipo 2 con un tratamiento promedio duración de 3.75 años. RECORD incluye pacientes que han fallado la monoterapia con metformina o sulfonilurea; aquellos que han fallado en la metformina son asignados al azar para recibir AVANDIA adicional o sulfonilurea adicional, y aquellos que han fallado la sulfonilurea son asignados al azar para recibir AVANDIA o complemento metformina En RECORD, un total de 2.220 pacientes reciben AVANDIA complementaria, y 2.227 pacientes están en uno de los regímenes complementarios que no contienen AVANDIA.
Para estos 3 ensayos, los análisis se realizaron utilizando un compuesto de eventos cardiovasculares adversos mayores (infarto de miocardio, muerte cardiovascular o accidente cerebrovascular), denominado en adelante MACE. Este punto final difería del punto final amplio del metaanálisis de los eventos isquémicos miocárdicos, de los cuales más de la mitad eran angina. El infarto de miocardio incluyó infarto de miocardio fatal y no fatal adjudicado más muerte súbita. Como se muestra en la Figura 2, los resultados para los 3 puntos finales (MACE, MI y Mortalidad total) no fueron estadísticamente diferentes entre AVANDIA y los comparadores.

En análisis preliminares del ensayo DREAM, la incidencia de eventos cardiovasculares fue mayor entre los sujetos que recibió AVANDIA en combinación con ramipril que entre los sujetos que recibieron ramipril solo, como se ilustra en Figura 2. Este hallazgo no se confirmó en ADOPT y RECORD (ensayos controlados activos en pacientes con diabetes) en los que 30% y 40% de los pacientes, respectivamente, informaron el uso de inhibidores de la ECA al inicio del estudio.
En su totalidad, los datos disponibles sobre el riesgo de isquemia miocárdica no son concluyentes. Las conclusiones definitivas sobre este riesgo esperan la finalización de un estudio de resultados cardiovasculares adecuadamente diseñado.
No se han realizado estudios clínicos que establezcan evidencia concluyente de reducción del riesgo macrovascular con AVANDIA o cualquier otro medicamento antidiabético oral.
Insuficiencia cardíaca congestiva e isquemia miocárdica durante la administración conjunta de AVANDIA con insulina
En los estudios en los que se agregó AVANDIA a la insulina, AVANDIA aumentó el riesgo de insuficiencia cardíaca congestiva e isquemia miocárdica. (Ver Tabla 2.)
No se recomienda la administración conjunta de AVANDIA e insulina. [Ver Indicaciones y uso y ADVERTENCIAS Y PRECAUCIONES.]
En cinco ensayos de 26 semanas, controlados, aleatorizados, doble ciego, que se incluyeron en el metanálisis [ver ADVERTENCIAS Y PRECAUCIONES], los pacientes con diabetes mellitus tipo 2 fueron asignados al azar a la administración conjunta de AVANDIA e insulina (N = 867) o insulina (N = 663). En estos 5 ensayos, AVANDIA se agregó a la insulina. Estos ensayos incluyeron pacientes con diabetes de larga data (duración media de 12 años) y una alta prevalencia de enfermedades preexistentes. afecciones médicas, que incluyen neuropatía periférica, retinopatía, cardiopatía isquémica, enfermedad vascular y corazón congestivo fracaso. El número total de pacientes con insuficiencia cardíaca congestiva emergente fue de 21 (2,4%) y 7 (1,1%) en los grupos AVANDIA más insulina e insulina, respectivamente. El número total de pacientes con isquemia miocárdica emergente fue 24 (2.8%) y 9 (1.4%) en los grupos AVANDIA más insulina e insulina, respectivamente (OR 2.1 [IC 95% 0.9, 5.1]). Aunque la tasa de eventos para insuficiencia cardíaca congestiva e isquemia miocárdica fue baja en el estudio población, consistentemente, la tasa de eventos fue 2 veces o más alta con la administración conjunta de AVANDIA y insulina. Estos eventos cardiovasculares se observaron en las dosis diarias de 4 mg y 8 mg de AVANDIA. (Ver Tabla 2.)
Tabla 2. Ocurrencia de eventos cardiovasculares en 5 ensayos controlados de adición de AVANDIA al tratamiento con insulina establecido
| Evento* | AVANDIA + Insulina (n = 867) n (%) |
Insulina (n = 663) n (%) |
| Insuficiencia cardíaca congestiva | 21 (2.4%) | 7 (1.1%) |
| Isquemia miocardica | 24 (2.8%) | 9 (1.4%) |
| Compuesto de muerte cardiovascular, infarto de miocardio o accidente cerebrovascular | 10 (1.2%) | 5 (0.8%) |
| Carrera | 5 (0.6%) | 4 (0.6%) |
| Infarto de miocardio | 4 (0.5%) | 1 (0.2%) |
| Muerte cardiovascular | 4 (0.5%) | 1 (0.2%) |
| Todas las muertes | 6 (0.7%) | 1 (0.2%) |
| * Los eventos no son exclusivos; es decir, un paciente con una muerte cardiovascular debido a un infarto de miocardio se contaría en 4 categorías de eventos (isquemia miocárdica; muerte cardiovascular, infarto de miocardio o accidente cerebrovascular; infarto de miocardio; muerte cardiovascular). |
En un sexto ensayo aleatorizado, doble ciego, controlado, de 24 semanas, de AVANDIA y la administración conjunta de insulina, se agregó insulina a AVANDAMET® (maleato de rosiglitazona y metformina HCl) (n = 161) y en comparación con insulina más placebo (n = 158), después de un encuentro ciego simple de 8 semanas con AVANDAMET Los pacientes con edema que requieren terapia farmacológica y aquellos con insuficiencia cardíaca congestiva fueron excluidos al inicio del estudio y durante el período de preinclusión.
En el grupo que recibió AVANDAMET más insulina, hubo un evento isquémico miocárdico y una muerte súbita. No se observó isquemia miocárdica en el grupo de insulina, y no se informó insuficiencia cardíaca congestiva en ninguno de los grupos de tratamiento.
Edema
AVANDIA debe usarse con precaución en pacientes con edema. En un estudio clínico en voluntarios sanos que recibieron 8 mg de AVANDIA una vez al día durante 8 semanas, hubo un aumento estadísticamente significativo en el volumen plasmático medio en comparación con el placebo.
Dado que las tiazolidinedionas, incluida la rosiglitazona, pueden causar retención de líquidos, lo que puede exacerbar o conducir a insuficiencia cardíaca congestiva, AVANDIA se debe utilizar con precaución en pacientes con riesgo de sufrir enfermedades fracaso. Los pacientes deben ser monitorizados para detectar signos y síntomas de insuficiencia cardíaca [ver ADVERTENCIA EN CAJA, ADVERTENCIAS Y PRECAUCIONES ].
En ensayos clínicos controlados de pacientes con diabetes tipo 2, se notificó edema leve a moderado en pacientes tratados con AVANDIA y puede estar relacionado con la dosis. Los pacientes con edema continuo eran más propensos a tener eventos adversos asociados con el edema si comenzaban con una terapia combinada con insulina y AVANDIA [ver REACCIONES ADVERSAS].
Aumento de peso
El aumento de peso relacionado con la dosis se observó con AVANDIA solo y en combinación con otros agentes hipoglucemiantes (Tabla 3). El mecanismo de aumento de peso no está claro, pero probablemente implica una combinación de retención de líquidos y acumulación de grasa.
En la experiencia posterior a la comercialización, ha habido informes de aumentos inusualmente rápidos de peso y aumentos superiores a los observados generalmente en ensayos clínicos. Los pacientes que experimentan tales aumentos deben ser evaluados por acumulación de líquido y eventos relacionados con el volumen, como edema excesivo e insuficiencia cardíaca congestiva [ver ADVERTENCIA EN CAJA].
Tabla 3. Cambios de peso (kg) desde el inicio hasta el punto final durante los ensayos clínicos
| Monoterapia | Duración | Grupo de control | AVANDIA 4 mg Mediana (25, 75 percentil) |
AVANDIA 8 mg Mediana (25, 75 percentil) |
|
| Mediana (25, 75 percentil) | |||||
| 26 semanas | placebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 semanas | sulfonilurea | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Terapia de combinación | |||||
| Sulfonilurea | 24-26 semanas | sulfonilurea | 0 (-1.0, 1.3) n = 1,155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| Metformina | 26 semanas | metformina | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| Insulina | 26 semanas | insulina | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonilurea + metformina | 26 semanas | sulfonilurea + metformina | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
En un ensayo comparativo de 4 a 6 años en monoterapia (ADOPT) en pacientes recientemente diagnosticados con diabetes tipo 2 no tratados previamente con medicamentos antidiabéticos [ver Estudio clínicos], la mediana del cambio de peso (25th, 75th percentiles) desde el inicio a los 4 años fue de 3.5 kg (0.0, 8.1) para AVANDIA, 2.0 kg (-1.0, 4.8) para gliburida y -2.4 kg (-5.4, 0.5) para metformina.
En un estudio de 24 semanas en pacientes pediátricos de 10 a 17 años tratados con AVANDIA de 4 a 8 mg diarios, un aumento de peso medio de 2.8 kg (25th, 75th percentiles: 0.0, 5.8) se informó.
Efectos hepáticos
Las enzimas hepáticas deben medirse antes del inicio de la terapia con AVANDIA en todos los pacientes y, posteriormente, periódicamente según el criterio clínico del profesional sanitario. La terapia con AVANDIA no debe iniciarse en pacientes con un aumento de los niveles basales de enzimas hepáticas (ALT> 2,5 veces el límite superior de la normalidad). Pacientes con enzimas hepáticas levemente elevadas (niveles de ALT â ‰ ¤ 2,5 veces el límite superior de la normalidad) al inicio del estudio o durante la terapia con AVANDIA debe evaluarse para determinar la causa de la enzima hepática elevación. El inicio o la continuación de la terapia con AVANDIA en pacientes con elevaciones leves de las enzimas hepáticas deben realizarse con precaución. e incluir un seguimiento clínico estrecho, incluido el control de las enzimas hepáticas, para determinar si se resuelven o aumentan empeorar. Si en algún momento los niveles de ALT aumentan a> 3 veces el límite superior de la normalidad en pacientes en tratamiento con AVANDIA, los niveles de enzimas hepáticas deben volver a comprobarse lo antes posible. Si los niveles de ALT permanecen> 3 veces el límite superior de lo normal, la terapia con AVANDIA debe suspenderse.
Si algún paciente desarrolla síntomas que sugieran disfunción hepática, que puede incluir náuseas, vómitos, dolor abdominal, fatiga, anorexia y / u orina oscura sin explicación, se deben controlar las enzimas hepáticas. La decisión de continuar con el tratamiento del paciente con AVANDIA debe guiarse por el juicio clínico en espera de las evaluaciones de laboratorio. Si se observa ictericia, se debe suspender el tratamiento farmacológico. [Ver REACCIONES ADVERSAS.]
Edema macular
Se ha informado de edema macular en la experiencia posterior a la comercialización en algunos pacientes diabéticos que estaban tomando AVANDIA u otra tiazolidinediona. Algunos pacientes presentaron visión borrosa o disminución de la agudeza visual, pero algunos pacientes parecen haber sido diagnosticados en un examen oftalmológico de rutina. La mayoría de los pacientes tenían edema periférico cuando se diagnosticó el edema macular. Algunos pacientes mejoraron su edema macular después de la interrupción de su tiazolidinediona. Los pacientes con diabetes deben someterse a exámenes oculares regulares por parte de un oftalmólogo, según los Estándares de Atención de la Asociación Americana de Diabetes. Además, cualquier diabético que reporte cualquier tipo de síntoma visual debe ser remitido de inmediato a un oftalmólogo, independientemente de los medicamentos subyacentes del paciente u otros hallazgos físicos. [Ver REACCIONES ADVERSAS.]
Fracturas
En un estudio comparativo de 4 a 6 años (ADOPT) del control glucémico con monoterapia en pacientes sin tratamiento farmacológico recientemente diagnosticado con diabetes mellitus tipo 2, se observó una mayor incidencia de fractura ósea en pacientes mujeres que tomaban AVANDIA Durante el período de 4 a 6 años, la incidencia de fractura ósea en mujeres fue del 9,3% (60/645) para AVANDIA frente al 3,5% (21/605) para la gliburida y el 5,1% (30/590) para la metformina. Este aumento de la incidencia se observó después del primer año de tratamiento y persistió durante el curso del estudio. La mayoría de las fracturas en las mujeres que recibieron AVANDIA ocurrieron en la parte superior del brazo, la mano y el pie. Estos sitios de fractura son diferentes de los que generalmente se asocian con osteoporosis posmenopáusica (p. Ej., Cadera o columna). No se observó aumento en las tasas de fracturas en los hombres tratados con AVANDIA. El riesgo de fractura debe considerarse en la atención de pacientes, especialmente pacientes femeninos, tratados con AVANDIA, y atención dada a evaluar y mantener la salud ósea de acuerdo con los estándares actuales de cuidado.
Efectos hematológicos
Las disminuciones en la hemoglobina y el hematocrito medios ocurrieron de manera relacionada con la dosis en pacientes adultos tratados con AVANDIA [ver REACCIONES ADVERSAS]. Los cambios observados pueden estar relacionados con el aumento del volumen plasmático observado con el tratamiento con AVANDIA.
Control de diabetes y glucosa en sangre
Los pacientes que reciben AVANDIA en combinación con otros agentes hipoglucemiantes pueden estar en riesgo de hipoglucemia, y puede ser necesaria una reducción de la dosis del agente concomitante.
Se deben realizar mediciones periódicas de glucosa en sangre en ayunas y HbA1c para controlar la respuesta terapéutica.
Ovulación
La terapia con AVANDIA, como otras tiazolidinedionas, puede provocar la ovulación en algunas mujeres anovulatorias premenopáusicas. Como resultado, estos pacientes pueden tener un mayor riesgo de embarazo mientras toman AVANDIA [ver Uso en poblaciones específicas]. Por lo tanto, se debe recomendar la anticoncepción adecuada en mujeres premenopáusicas. Este posible efecto no se ha investigado específicamente en estudios clínicos; por lo tanto, se desconoce la frecuencia de este hecho.
Aunque el desequilibrio hormonal se ha visto en estudios preclínicos [ver Toxicología no clínica], se desconoce la importancia clínica de este hallazgo. Si ocurre una disfunción menstrual inesperada, se deben revisar los beneficios de la terapia continua con AVANDIA.
parte superior
Reacciones adversas
Experiencia en ensayos clínicos
Adulto
En ensayos clínicos, aproximadamente 9,900 pacientes con diabetes tipo 2 han sido tratados con AVANDIA.
Ensayos a corto plazo de AVANDIA como monoterapia y en combinación con otros agentes hipoglucemiantes
La tabla 4 muestra la incidencia y los tipos de eventos adversos informados en ensayos clínicos a corto plazo de AVANDIA como monoterapia.
Tabla 4. Eventos adversos (â ‰ ¥ 5% en cualquier grupo de tratamiento) informados por pacientes en ensayos clínicos a corto plazo * doble ciego con AVANDIA como monoterapia
| Término preferido | AVANDIA Monoterapia N = 2,526 % |
Placebo N = 601 % |
Metformina N = 225 % |
Sulfonilureasâ € N = 626 % |
| Infección del tracto respiratorio superior | 9.9 | 8.7 | 8.9 | 7.3 |
| Lesión | 7.6 | 4.3 | 7.6 | 6.1 |
| Dolor de cabeza | 5.9 | 5.0 | 8.9 | 5.4 |
| Dolor de espalda | 4.0 | 3.8 | 4.0 | 5.0 |
| Hiperglucemia | 3.9 | 5.7 | 4.4 | 8.1 |
| Fatiga | 3.6 | 5.0 | 4.0 | 1.9 |
| Sinusitis | 3.2 | 4.5 | 5.3 | 3.0 |
| Diarrea | 2.3 | 3.3 | 15.6 | 3.0 |
| Hipoglucemia | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Los ensayos a corto plazo variaron de 8 semanas a 1 año. †Incluye pacientes que reciben gliburida (N = 514), gliclazida (N = 91) o glipizida (N = 21). |
En general, los tipos de reacciones adversas sin tener en cuenta la causalidad informaron cuando se utilizó AVANDIA en combinación con una sulfonilurea o metformina fueron similares a los de la monoterapia con AVANDIA
Los eventos de anemia y edema tendieron a notificarse con mayor frecuencia a dosis más altas, y en general fueron de gravedad leve a moderada y generalmente no requirieron la interrupción del tratamiento con AVANDIA.
En estudios doble ciego, se notificó anemia en el 1,9% de los pacientes que recibieron AVANDIA como monoterapia en comparación con el 0,7% con placebo, el 0,6% con sulfonilureas y el 2,2% con metformina. Los informes de anemia fueron mayores en pacientes tratados con una combinación de AVANDIA y metformina (7,1%) y con una combinación de AVANDIA y una sulfonilurea más metformina (6,7%) en comparación con la monoterapia con AVANDIA o en combinación con una sulfonilurea (2.3%). Los niveles más bajos de hemoglobina / hematocrito previos al tratamiento en pacientes inscritos en los ensayos clínicos de combinación de metformina pueden haber contribuido a la mayor tasa de anemia en estos estudios [ver REACCIONES ADVERSAS].
En ensayos clínicos, se notificó edema en el 4,8% de los pacientes que recibieron AVANDIA como monoterapia en comparación con el 1,3% con placebo, el 1,0% con sulfonilureas y el 2,2% con metformina. La tasa de edema informada fue mayor para AVANDIA 8 mg en combinaciones de sulfonilurea (12.4%) en comparación con otras combinaciones, con la excepción de la insulina. Se informó edema en el 14,7% de los pacientes que recibieron AVANDIA en los ensayos de combinación de insulina en comparación con el 5,4% con insulina sola. Los informes de nuevo inicio o exacerbación de la insuficiencia cardíaca congestiva ocurrieron a tasas de 1% para insulina sola, y 2% (4 mg) y 3% (8 mg) para insulina en combinación con AVANDIA [ver ADVERTENCIA EN CAJA y ADVERTENCIAS Y PRECAUCIONES].
En estudios de terapia de combinación controlada con sulfonilureas, se informaron síntomas hipoglucémicos leves a moderados, que parecen estar relacionados con la dosis. Pocos pacientes fueron retirados por hipoglucemia (<1%) y pocos episodios de hipoglucemia se consideraron graves (<1%). La hipoglucemia fue el evento adverso reportado con mayor frecuencia en los ensayos de combinación de insulina de dosis fija, aunque pocos pacientes se retiraron por hipoglucemia (4 de 408 para AVANDIA más insulina y 1 de 203 para insulina solo). Las tasas de hipoglucemia, confirmadas por la concentración de glucosa en sangre capilar â ‰ ¤ 50 mg / dL, fueron 6% para insulina sola y 12% (4 mg) y 14% (8 mg) para insulina en combinación con AVANDIA. [Ver ADVERTENCIAS Y PRECAUCIONES.]
Ensayo a largo plazo de AVANDIA como monoterapia
Un estudio de 4 a 6 años (ADOPT) comparó el uso de AVANDIA (n = 1,456), gliburida (n = 1,441) y metformina (n = 1,454) como monoterapia en pacientes recientemente diagnosticados con diabetes tipo 2 que no fueron tratados previamente con antidiabéticos medicación. La Tabla 5 presenta reacciones adversas sin tener en cuenta la causalidad; las tasas se expresan por 100 pacientes-años de exposición (PY) para tener en cuenta las diferencias en la exposición a la medicación del estudio en los 3 grupos de tratamiento.
En ADOPT, se informaron fracturas en un mayor número de mujeres tratadas con AVANDIA (9.3%, 2.7 / 100 paciente-años) en comparación con gliburida (3.5%, 1.3 / 100 paciente-años) o metformina (5.1%, 1.5 / 100 paciente-años).
La mayoría de las fracturas en las mujeres que recibieron rosiglitazona se informaron en la parte superior del brazo, la mano y el pie. [Ver ADVERTENCIAS Y PRECAUCIONES.] La incidencia observada de fracturas en pacientes masculinos fue similar entre los 3 grupos de tratamiento.
Tabla 5. Eventos adversos en la terapia (â ‰ ¥ 5 Eventos / 100 pacientes-años [PY]) en cualquier grupo de tratamiento informado en un ensayo clínico de 4 a 6 años de AVANDIA como monoterapia (ADOPT)
| AVANDIA N = 1,456 PY = 4,954 |
Gliburida N = 1,441 PY = 4,244 |
Metformina N = 1,454 PY = 4,906 |
|
| Nasofaringitis | 6.3 | 6.9 | 6.6 |
| Dolor de espalda | 5.1 | 4.9 | 5.3 |
| Artralgia | 5.0 | 4.8 | 4.2 |
| Hipertensión | 4.4 | 6.0 | 6.1 |
| Infección del tracto respiratorio superior | 4.3 | 5.0 | 4.7 |
| Hipoglucemia | 2.9 | 13.0 | 3.4 |
| Diarrea | 2.5 | 3.2 | 6.8 |
Pediátrico
Se ha evaluado la seguridad de Avandia en un único ensayo controlado con control activo de pacientes pediátricos con diabetes tipo 2 en el que 99 fueron tratados con Avandia y 101 con metformina. Las reacciones adversas más comunes (> 10%) sin tener en cuenta la causalidad de Avandia o metformina fueron dolor de cabeza (17% versus 14%), náuseas (4% versus 11%), nasofaringitis (3% versus 12%) y diarrea (1% versus 13%). En este estudio, se informó un caso de cetoacidosis diabética en el grupo de metformina. Además, había 3 pacientes en el grupo de rosiglitazona que tenían FPG de ¼300 mg / dL, cetonuria 2+ y una brecha aniónica elevada.
Anomalías de laboratorio
Hematológico
Las disminuciones en la hemoglobina y el hematocrito medios ocurrieron de forma relacionada con la dosis en pacientes adultos tratados con Avandia (disminución media en estudios individuales de hasta 1.0 g / dL de hemoglobina y hasta 3.3% hematocrito). Los cambios ocurrieron principalmente durante los primeros 3 meses después del inicio de la terapia con Avandia o después de un aumento de dosis en Avandia. El curso temporal y la magnitud de las disminuciones fueron similares en pacientes tratados con una combinación de Avandia y otros agentes hipoglucemiantes o monoterapia con Avandia. Los niveles previos al tratamiento de hemoglobina y hematocrito fueron más bajos en pacientes en estudios de combinación de metformina y pueden haber contribuido a la mayor tasa de anemia. En un solo estudio en pacientes pediátricos, se informaron disminuciones en la hemoglobina y el hematocrito (disminuciones medias de 0.29 g / dL y 0.95%, respectivamente). También se han informado pequeñas disminuciones en la hemoglobina y el hematocrito en pacientes pediátricos tratados con Avandia. Los recuentos de glóbulos blancos también disminuyeron ligeramente en pacientes adultos tratados con Avandia. La disminución de los parámetros hematológicos puede estar relacionada con el aumento del volumen plasmático observado con el tratamiento con Avandia.
Lípidos
Se han observado cambios en los lípidos séricos después del tratamiento con Avandia en adultos [ver Farmacología Clínica ]. Se informaron pequeños cambios en los parámetros de los lípidos en suero en niños tratados con Avandia durante 24 semanas.
Niveles de transaminasas séricas
En estudios clínicos previos a la aprobación en 4.598 pacientes tratados con Avandia (3.600 pacientes-años de exposición) y en un período prolongado de 4 a Estudio de 6 años en 1.456 pacientes tratados con Avandia (exposición de 4.954 pacientes-años), no hubo evidencia de fármacos inducidos hepatotoxicidad
En ensayos controlados previos a la aprobación, el 0.2% de los pacientes tratados con Avandia tuvieron elevaciones en ALT> 3X el límite superior de la normalidad en comparación con 0.2% con placebo y 0.5% en comparadores activos. Las elevaciones de ALT en pacientes tratados con Avandia fueron reversibles. Se encontró hiperbilirrubinemia en 0.3% de los pacientes tratados con Avandia en comparación con 0.9% tratados con placebo y 1% en pacientes tratados con comparadores activos. En los ensayos clínicos previos a la aprobación, no hubo casos de reacciones farmacológicas idiosincráticas que condujeran a insuficiencia hepática. [Ver Advertencias y precauciones]
En el ensayo ADOPT de 4 a 6 años, pacientes tratados con Avandia (exposición de 4,954 años-paciente), gliburida (exposición de 4,244 años-paciente), o metformina (exposición de 4.906 años-paciente), como monoterapia, tuvo la misma tasa de aumento de ALT a> 3 veces el límite superior normal (0.3 por 100 años-paciente) exposición).
Experiencia posterior a la comercialización
Además de las reacciones adversas informadas en los ensayos clínicos, los eventos descritos a continuación se identificaron durante el uso de Avandia posterior a la aprobación. Debido a que estos eventos se informan voluntariamente de una población de tamaño desconocido, no es posible estimar de manera confiable su frecuencia o establecer siempre una relación causal con la exposición al fármaco.
En pacientes que reciben terapia con tiazolidinediona, los eventos adversos graves con o sin un desenlace fatal, potencialmente Se han notificado casos relacionados con la expansión del volumen (p. ej., insuficiencia cardíaca congestiva, edema pulmonar y derrames pleurales). [ver Advertencia en caja y Advertencias y precauciones].
Hay informes posteriores a la comercialización con Avandia de hepatitis, elevaciones de enzimas hepáticas a 3 o más veces límite superior de la normalidad e insuficiencia hepática con y sin desenlace fatal, aunque no se ha observado la causalidad establecido.
Raramente se ha informado erupción cutánea, prurito, urticaria, angioedema, reacción anafiláctica y síndrome de Stevens-Johnson.
También se han recibido informes de nuevo inicio o empeoramiento del edema macular diabético con disminución de la agudeza visual [ver Advertencias y precauciones].
parte superior
Interacciones con la drogas
Inhibidores e inductores de CYP2C8
Un inhibidor de CYP2C8 (por ejemplo, gemfibrozil) puede aumentar el AUC de rosiglitazona y un inductor de CYP2C8 (por ejemplo, rifampicina) puede disminuir el AUC de rosiglitazona. Por lo tanto, si se inicia o detiene un inhibidor o un inductor de CYP2C8 durante el tratamiento con rosiglitazona, pueden ser necesarios cambios en el tratamiento de la diabetes según la respuesta clínica. [Ver FARMACOLOGÍA CLÍNICA.]
parte superior
Uso en poblaciones específicas
El embarazo
Embarazo Categoría C.
Todos los embarazos tienen un riesgo de defectos congénitos, pérdida u otro resultado adverso, independientemente de la exposición al medicamento. Este riesgo de fondo aumenta en los embarazos complicados por hiperglucemia y puede disminuir con un buen control metabólico. Es esencial que los pacientes con diabetes o antecedentes de diabetes gestacional mantengan un buen control metabólico antes de la concepción y durante todo el embarazo. El monitoreo cuidadoso del control de glucosa es esencial en tales pacientes. La mayoría de los expertos recomiendan que se use monoterapia con insulina durante el embarazo para mantener los niveles de glucosa en sangre lo más cerca posible de lo normal.
Datos humanos: Se ha informado que la rosiglitazona cruza la placenta humana y es detectable en el tejido fetal. La importancia clínica de estos hallazgos es desconocida. No existen estudios adecuados y bien controlados en mujeres embarazadas. AVANDIA no debe usarse durante el embarazo.
Estudios en animales: No hubo efecto sobre la implantación o el embrión con tratamiento con rosiglitazona durante el embarazo temprano en ratas, pero El tratamiento durante la gestación media-tardía se asoció con la muerte fetal y el retraso del crecimiento tanto en ratas como en conejos. No se observó teratogenicidad a dosis de hasta 3 mg / kg en ratas y 100 mg / kg en conejos (aproximadamente 20 y 75 veces el AUC humano a la dosis diaria máxima recomendada en humanos, respectivamente). La rosiglitazona causó patología placentaria en ratas (3 mg / kg / día). El tratamiento de las ratas durante la gestación durante la lactancia redujo el tamaño de la camada, la viabilidad neonatal y el crecimiento postnatal, con un retraso del crecimiento reversible después de la pubertad. Para los efectos sobre la placenta, el embrión / feto y la descendencia, la dosis sin efecto fue de 0.2 mg / kg / día en ratas y 15 mg / kg / día en conejos. Estos niveles sin efecto son aproximadamente 4 veces el AUC humano a la dosis diaria máxima recomendada en humanos. La rosiglitazona redujo el número de implantes uterinos y crías vivas cuando las ratas hembras juveniles fueron tratadas a los 40 mg / kg / día desde los 27 días de edad hasta la madurez sexual (aproximadamente 68 veces el AUC humano al máximo recomendado diariamente dosis). El nivel sin efecto fue de 2 mg / kg / día (aproximadamente 4 veces el AUC humano a la dosis diaria máxima recomendada). No hubo efecto sobre la supervivencia o el crecimiento prenatal o postnatal.
Trabajo y entrega
Se desconoce el efecto de rosiglitazone en el trabajo de parto y el parto en humanos.
Madres lactantes
Se detectó material relacionado con las drogas en la leche de ratas lactantes. No se sabe si AVANDIA se excreta en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana, AVANDIA no debe administrarse a una mujer lactante.
Uso pediátrico
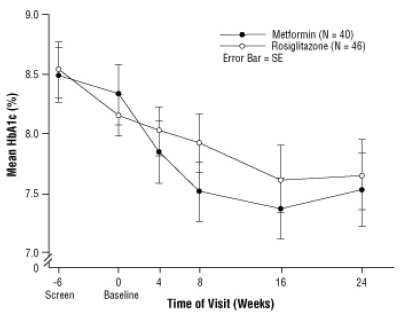
Después de la intervención con placebo, incluido el asesoramiento dietético, niños con diabetes mellitus tipo 2, de 10 a 17 años y con un índice de masa corporal (IMC) medio basal de 33 kg / m, fueron asignados al azar al tratamiento con 2 mg dos veces al día de AVANDIA (n = 99) o 500 mg dos veces al día de metformina (n = 101) en un estudio clínico doble ciego de 24 semanas juicio. Como era de esperar, la FPG disminuyó en pacientes que no habían recibido la medicación para la diabetes (n = 104) y aumentó en los pacientes que se retiraron de la medicación previa (generalmente metformina) (n = 90) durante el período inicial. Después de al menos 8 semanas de tratamiento, el 49% de los pacientes tratados con AVANDIA y el 55% de los pacientes tratados con metformina duplicaron su dosis si FPG> 126 mg / dL. Para la población general con intención de tratar, en la semana 24, el cambio medio desde el inicio en HbA1c fue -0.14% con AVANDIA y -0.49% con metformina. Hubo un número insuficiente de pacientes en este estudio para establecer estadísticamente si estos
Los efectos medios observados del tratamiento fueron similares o diferentes. Los efectos del tratamiento fueron diferentes para los pacientes que no habían recibido la terapia antidiabética y para los pacientes tratados previamente con terapia antidiabética (Tabla 6).
Tabla 6. La semana 24 FPG y HbA1c cambian desde el inicio de la última observación realizada en niños con un valor basal de HbA1c> 6.5%
| Pacientes ingenuos | Pacientes tratados previamente | |||
|
Metformina N = 40 |
Rosiglitazona N = 45 |
Metformina N = 43 |
Rosiglitazona N = 32 |
|
| FPG (mg / dL) | ||||
| Línea de base (media) | 170 | 165 | 221 | 205 |
| Cambio desde el inicio (media) | -21 | -11 | -33 | -5 |
| Diferencia de tratamiento ajustada * (rosiglitazone-metformin) â € (IC 95%) | 8 (-15, 30) |
21 (-9, 51) |
||
| El% de pacientes con disminución de ¥ 30 mg / dL desde el inicio | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Línea de base (media) | 8.3 | 8.2 | 8.8 | 8.5 |
| Cambio desde el inicio (media) | -0.7 | -0.5 | -0.4 | 0.1 |
| Diferencia de tratamiento ajustada * (rosiglitazone-metformin) â € (IC 95%) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % de pacientes con â â ¥ 0.7% de disminución desde el inicio | 63% | 52% | 54% | 31% |
|
* Cambiar desde la línea de base significa mínimos cuadrados significa ajustar para la línea de base HbA1c, género y región. †Los valores positivos para la diferencia favorecen a la metformina. |
Las diferencias de tratamiento dependieron del IMC o el peso basal de manera que los efectos de AVANDIA y metformina parecían más comparables entre los pacientes más pesados. La mediana del aumento de peso fue de 2,8 kg con rosiglitazona y 0,2 kg con metformina [ver ADVERTENCIAS Y PRECAUCIONES]. El 54% de los pacientes tratados con rosiglitazona y el 32% de los pacientes tratados con metformina ganaron â ‰ ¥ 2 kg, y el 33% de los pacientes tratados con rosiglitazona y el 7% de los pacientes tratados con metformina ganaron â ‰ ¥ 5 kg en estudiar.
Los eventos adversos observados en este estudio se describen en Reacciones adversas).
Figura 3. HbA1c media a lo largo del tiempo en un estudio de 24 semanas de AVANDIA y metformina en pacientes pediátricos - Subgrupo de fármacos sin tratamiento previo
Uso geriátrico
Los resultados del análisis farmacocinético de la población mostraron que la edad no afecta significativamente la farmacocinética de rosiglitazona [ver FARMACOLOGÍA CLÍNICA]. Por lo tanto, no se requieren ajustes de dosis para los ancianos. En los ensayos clínicos controlados, no se observaron diferencias generales en la seguridad y la efectividad entre los pacientes mayores (≤ 65 años) y los más jóvenes (<65 años).
parte superior
Sobredosis
Se dispone de datos limitados con respecto a la sobredosis en humanos. En estudios clínicos en voluntarios, AVANDIA se ha administrado en dosis orales únicas de hasta 20 mg y fue bien tolerado. En caso de sobredosis, se debe iniciar un tratamiento de soporte adecuado según lo indique el estado clínico del paciente.
parte superior
Descripción
AVANDIA (maleato de rosiglitazona) es un agente antidiabético oral que actúa principalmente al aumentar la sensibilidad a la insulina. AVANDIA mejora el control glucémico al tiempo que reduce los niveles circulantes de insulina.
El maleato de rosiglitazona no está relacionado química o funcionalmente con las sulfonilureas, las biguanidas o los inhibidores de la alfa-glucosidasa.
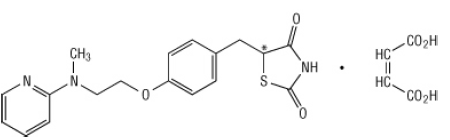
Químicamente, el maleato de rosiglitazona es (±) -5 - [[4- [2- (metil-2-piridinilamino) etoxi] fenil] metil] -2,4-tiazolidinediona, (Z) -2-butenodioato (1: 1) con un peso molecular de 473.52 (357.44 base libre). La molécula tiene un solo centro quiral y está presente como un racemato. Debido a la rápida interconversión, los enantiómeros son funcionalmente indistinguibles. La fórmula estructural del maleato de rosiglitazona es:
La fórmula molecular es C18H19N3O3S-C4H4O4. El maleato de rosiglitazona es un sólido blanco a blanquecino con un rango de punto de fusión de 122 a 123 ° C. Los valores de pKa del maleato de rosiglitazona son 6.8 y 6.1. Es fácilmente soluble en etanol y un solución acuosa tamponada con pH de 2,3; la solubilidad disminuye al aumentar el pH en el fisiológico rango.
Cada comprimido TILTAB recubierto con película pentagonal contiene maleato de rosiglitazona equivalente a rosiglitazona, 2 mg, 4 mg u 8 mg, para administración oral. Los ingredientes inactivos son: hipromelosa 2910, lactosa monohidrato, estearato de magnesio, celulosa microcristalina, polietilenglicol. 3000, almidón glicolato sódico, dióxido de titanio, triacetina y 1 o más de los siguientes: óxidos de hierro sintéticos rojos y amarillos y talco.
parte superior
Farmacología Clínica
Mecanismo de acción
La rosiglitazona, un miembro de la clase de agentes antidiabéticos tiazolidinediona, mejora el control glucémico al mejorar la sensibilidad a la insulina. La rosiglitazona es un agonista altamente selectivo y potente para el receptor gamma activado por proliferador de peroxisomas (PPARγ). En los humanos, los receptores PPAR se encuentran en tejidos diana clave para la acción de la insulina, como el tejido adiposo, el músculo esquelético y el hígado. La activación de los receptores nucleares PPARγ regula la transcripción de los genes sensibles a la insulina involucrados en el control de la producción, transporte y utilización de glucosa. Además, los genes que responden a PPARγ también participan en la regulación del metabolismo de los ácidos grasos.
La resistencia a la insulina es una característica común que caracteriza la patogénesis de la diabetes tipo 2. La actividad antidiabética de rosiglitazone se ha demostrado en modelos animales de diabetes tipo 2 en qué hiperglucemia y / o tolerancia alterada a la glucosa es una consecuencia de la resistencia a la insulina en el objetivo tejidos La rosiglitazona reduce las concentraciones de glucosa en sangre y reduce la hiperinsulinemia en el ratón obeso ob / ob, el ratón diabético db / db y la rata Zucker grasa fa / fa.
En modelos animales, se demostró que la actividad antidiabética de la rosiglitazona está mediada por una mayor sensibilidad a la acción de la insulina en el hígado, los músculos y los tejidos adiposos. Los estudios farmacológicos en modelos animales indican que la rosiglitazona inhibe la gluconeogénesis hepática. La expresión del transportador de glucosa regulado por insulina GLUT-4 aumentó en el tejido adiposo. La rosiglitazona no indujo hipoglucemia en modelos animales de diabetes tipo 2 y / o intolerancia a la glucosa.
Farmacodinámica
Los pacientes con anormalidades lipídicas no fueron excluidos de los ensayos clínicos de AVANDIA.
En todos los ensayos controlados de 26 semanas, en el rango de dosis recomendado, AVANDIA como monoterapia se asoció con aumentos en el colesterol total, LDL y HDL y disminuciones en los ácidos grasos libres. Estos cambios fueron estadísticamente significativamente diferentes de los controles con placebo o gliburida (Tabla 7).
Los aumentos en LDL ocurrieron principalmente durante los primeros 1 a 2 meses de terapia con AVANDIA y los niveles de LDL se mantuvieron elevados por encima de la línea de base a lo largo de los ensayos. En contraste, HDL continuó aumentando con el tiempo. Como resultado, la relación LDL / HDL alcanzó su punto máximo después de 2 meses de terapia y luego pareció disminuir con el tiempo. Debido a la naturaleza temporal de los cambios en los lípidos, el estudio controlado con gliburida de 52 semanas es más pertinente para evaluar los efectos a largo plazo sobre los lípidos. Al inicio, en la semana 26 y en la semana 52, las relaciones medias de LDL / HDL fueron 3.1, 3.2 y 3.0, respectivamente, para AVANDIA 4 mg dos veces al día. Los valores correspondientes para gliburida fueron 3.2, 3.1 y 2.9. Las diferencias en el cambio desde el inicio entre AVANDIA y gliburida en la semana 52 fueron estadísticamente significativas.
El patrón de cambios de LDL y HDL después de la terapia con AVANDIA en combinación con otros agentes hipoglucemiantes fue generalmente similar a los observados con AVANDIA en monoterapia.
Los cambios en los triglicéridos durante la terapia con AVANDIA fueron variables y generalmente no fueron estadísticamente diferentes de los controles con placebo o gliburida.
Tabla 7. Resumen de los cambios medios en los lípidos en estudios de monoterapia controlados con placebo y de 52 semanas controlados con placebo y 52 semanas
| Estudios controlados con placebo Semana 26 | Estudio controlado por gliburida Semana 26 y Semana 52 | ||||||
| Placebo | AVANDIA | Titulación de gliburida | AVANDIA 8 mg | ||||
| 4 mg diarios * | 8 mg diarios * | Semana 26 | Semana 52 | Semana 26 | Semana 52 | ||
| Ácidos grasos libres | |||||||
| norte | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Línea de base (media)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Cambio desde el inicio (media) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| norte | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Línea de base (media)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Cambio desde el inicio (media) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| norte | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Línea de base (media)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Cambio desde el inicio (media) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Se combinaron grupos de dosificación una vez al día y dos veces al día. |
Farmacocinética
La concentración plasmática máxima (Cmáx) y el área bajo la curva (AUC) de rosiglitazona aumentan de manera proporcional a la dosis en el rango de dosis terapéutica (Tabla 8). La vida media de eliminación es de 3 a 4 horas y es independiente de la dosis.
Tabla 8. Parámetros farmacocinéticos medios (DE) para rosiglitazona después de dosis orales únicas (N = 32)
| Parámetro | 1 mg en ayunas | 2 mg en ayunas | 8 mg en ayunas | 8 mg Fed |
| AUC0-inf [ng-hr / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Media vida [hora] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / hr] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = aclaramiento oral. |
Absorción
La biodisponibilidad absoluta de rosiglitazona es del 99%. Las concentraciones plasmáticas máximas se observan aproximadamente 1 hora después de la dosificación. La administración de rosiglitazona con alimentos no produjo cambios en la exposición general (AUC), pero hubo una disminución de aproximadamente el 28% en la Cmax y un retraso en la Tmax (1.75 horas). Es probable que estos cambios no sean clínicamente significativos; por lo tanto, AVANDIA puede administrarse con o sin alimentos.
Distribución
El volumen de distribución oral medio (CV%) (Vss / F) de rosiglitazona es de aproximadamente 17,6 (30%) litros, según un análisis farmacocinético de la población. La rosiglitazona se une aproximadamente al 99.8% a las proteínas plasmáticas, principalmente a la albúmina.
Metabolismo
La rosiglitazona se metaboliza ampliamente y no se excreta ningún fármaco inalterado en la orina. Las principales rutas del metabolismo fueron la N-desmetilación y la hidroxilación, seguidas de la conjugación con sulfato y ácido glucurónico. Todos los metabolitos circulantes son considerablemente menos potentes que los padres y, por lo tanto, no se espera que contribuyan a la actividad sensibilizadora de insulina de la rosiglitazona.
Los datos in vitro demuestran que la rosiglitazona se metaboliza predominantemente por la isoenzima 2C8 del citocromo P450 (CYP), y CYP2C9 contribuye como una vía menor.
Excreción
Después de la administración oral o intravenosa de maleato de rosiglitazona [14C], aproximadamente el 64% y el 23% de la dosis se eliminó en la orina y en las heces, respectivamente. La vida media plasmática del material relacionado con [14C] osciló entre 103 y 158 horas.
Farmacocinética de la población en pacientes con diabetes tipo 2
Análisis farmacocinéticos poblacionales de 3 grandes ensayos clínicos que incluyen 642 hombres y 405 mujeres con diabetes tipo 2 (35 años) a 80 años) demostró que la farmacocinética de rosiglitazona no está influenciada por la edad, la raza, el tabaquismo o el alcohol consumo. Se demostró que tanto el aclaramiento oral (CL / F) como el volumen de distribución oral en estado estacionario (Vss / F) aumentan con los aumentos en el peso corporal. Sobre el rango de peso observado en estos análisis (50 a 150 kg), el rango de valores predichos de CL / F y Vss / F varió en <1.7 veces y <2.3 veces, respectivamente.
Además, se demostró que la rosiglitazona CL / F está influenciada tanto por el peso como por el género, siendo menor (alrededor del 15%) en pacientes femeninas.
Poblaciones Especiales
Geriátrico
Resultados del análisis farmacocinético poblacional (n = 716 <65 años; n = 331 â ‰ ¥ 65 años) mostraron que la edad no afecta significativamente la farmacocinética de rosiglitazona.
Género
Los resultados del análisis de farmacocinética de la población mostraron que el aclaramiento oral medio de rosiglitazona en pacientes femeninos (n = 405) fueron aproximadamente un 6% más bajos en comparación con pacientes masculinos del mismo peso corporal (n = 642).
Como monoterapia y en combinación con metformina, AVANDIA mejoró el control glucémico tanto en hombres como en mujeres. En los estudios de combinación de metformina, se demostró la eficacia sin diferencias de género en la respuesta glucémica.
En estudios de monoterapia, se observó una mayor respuesta terapéutica en mujeres; sin embargo, en pacientes más obesos, las diferencias de género fueron menos evidentes. Para un índice de masa corporal (IMC) dado, las mujeres tienden a tener una mayor masa grasa que los hombres. Dado que el objetivo molecular PPARγ se expresa en tejidos adiposos, esta característica diferenciadora puede explicar, al menos en parte, la mayor respuesta a AVANDIA en las mujeres. Dado que la terapia debe ser individualizada, no es necesario ajustar la dosis solo por género.
Deterioro hepático
El aclaramiento oral libre de rosiglitazona fue significativamente menor en pacientes con enfermedad hepática moderada a grave (Child-Pugh Clase B / C) en comparación con sujetos sanos. Como resultado, la Cmax libre y AUC0-inf aumentaron 2 y 3 veces, respectivamente. La vida media de eliminación de rosiglitazona fue de aproximadamente 2 horas más en pacientes con enfermedad hepática, en comparación con sujetos sanos.
La terapia con AVANDIA no debe iniciarse si el paciente presenta evidencia clínica de actividad enfermedad hepática o aumento de los niveles de transaminasas séricas (ALT> 2.5 veces el límite superior de la normalidad) al inicio del estudio [ver ADVERTENCIAS Y PRECAUCIONES].
Pediátrico
Los parámetros farmacocinéticos de rosiglitazona en pacientes pediátricos se establecieron mediante un análisis farmacocinético poblacional con datos escasos de 96 pacientes pediátricos en un solo ensayo clínico pediátrico que incluye 33 hombres y 63 mujeres con edades que van de 10 a 17 años (pesos que varían de 35 a 178,3 kg). La población media de CL / F y V / F de rosiglitazona fue de 3.15 L / hy 13.5 L, respectivamente. Estas estimaciones de CL / F y V / F fueron consistentes con las estimaciones típicas de parámetros de un análisis previo de población adulta.
Insuficiencia renal
No existen diferencias clínicamente relevantes en la farmacocinética de rosiglitazona en pacientes con leves a insuficiencia renal grave o en pacientes dependientes de hemodiálisis en comparación con sujetos con insuficiencia renal normal función. Por lo tanto, no se requiere ajuste de dosis en tales pacientes que reciben AVANDIA. Dado que la metformina está contraindicada en pacientes con insuficiencia renal, la administración conjunta de metformina con AVANDIA está contraindicada en estos pacientes.
Carrera
Los resultados de un análisis farmacocinético poblacional que incluye sujetos de origen caucásico, negro y otros orígenes étnicos indican que la raza no tiene influencia en la farmacocinética de rosiglitazona.
Interacciones farmacológicas
Medicamentos que inhiben, inducen o son metabolizados por el citocromo P450
Los estudios de metabolismo de fármacos in vitro sugieren que la rosiglitazona no inhibe ninguna de las principales enzimas P450 a concentraciones clínicamente relevantes. Los datos in vitro demuestran que la rosiglitazona se metaboliza predominantemente por CYP2C8 y, en menor medida, 2C9. Se demostró que AVANDIA (4 mg dos veces al día) no tiene ningún efecto clínicamente relevante sobre la farmacocinética de nifedipina y anticonceptivos orales (etinilestradiol y noretindrona), que se metabolizan predominantemente por CYP3A4.
Gemfibrozil
Administración concomitante de gemfibrozilo (600 mg dos veces al día), un inhibidor de CYP2C8 y rosiglitazona (4 mg una vez diariamente) durante 7 días aumentó el AUC de rosiglitazona en un 127%, en comparación con la administración de rosiglitazona (4 mg una vez al día) solo. Dado el potencial de eventos adversos relacionados con la dosis con rosiglitazona, puede ser necesaria una disminución en la dosis de rosiglitazona cuando se introduce gemfibrozilo [ver INTERACCIONES CON LA DROGAS].
Rifampicina
Se informa que la administración de rifampicina (600 mg una vez al día), un inductor de CYP2C8, durante 6 días disminuye el AUC de rosiglitazona en un 66%, en comparación con la administración de rosiglitazona (8 mg) sola [ver INTERACCIONES CON LA DROGAS].4
Gliburida
AVANDIA (2 mg dos veces al día) tomado concomitantemente con gliburida (3.75 a 10 mg / día) durante 7 días no alteró Las concentraciones plasmáticas medias de glucosa en el estado estacionario de 24 horas en pacientes diabéticos estabilizados con gliburida terapia. Repetir las dosis de AVANDIA (8 mg una vez al día) durante 8 días en sujetos caucásicos adultos sanos causó una disminución en el AUC y la Cmáx de gliburida de aproximadamente 30%. En sujetos japoneses, el AUC y la Cmáx de gliburida aumentaron ligeramente después de la administración conjunta de AVANDIA.
Glimepirida
Las dosis orales únicas de glimepirida en 14 sujetos adultos sanos no tuvieron un efecto clínicamente significativo sobre la farmacocinética en estado estacionario de AVANDIA. No hay reducciones clínicamente significativas en el AUC y C de glimepiridamax se observaron después de dosis repetidas de AVANDIA (8 mg una vez al día) durante 8 días en sujetos adultos sanos.
Metformina
Administración simultánea de AVANDIA (2 mg dos veces al día) y metformina (500 mg dos veces al día) en pacientes sanos los voluntarios durante 4 días no tuvieron efecto sobre la farmacocinética en estado estacionario de metformina o rosiglitazone.
Acarbosa
La administración conjunta de acarbosa (100 mg tres veces al día) durante 7 días en voluntarios sanos no tuvo un efecto clínicamente relevante sobre la farmacocinética de una dosis oral única de AVANDIA.
Digoxina
La repetición de la administración oral de AVANDIA (8 mg una vez al día) durante 14 días no alteró la farmacocinética en estado estacionario de digoxina (0,375 mg una vez al día) en voluntarios sanos.
Warfarina
La administración repetida de AVANDIA no tuvo un efecto clínicamente relevante sobre la farmacocinética en estado estacionario de los enantiómeros de warfarina.
Etanol
Una sola administración de una cantidad moderada de alcohol no aumentó el riesgo de hipoglucemia aguda en pacientes con diabetes mellitus tipo 2 tratados con AVANDIA.
Ranitidina
El tratamiento previo con ranitidina (150 mg dos veces al día durante 4 días) no alteró la farmacocinética de las dosis orales o intravenosas únicas de rosiglitazona en voluntarios sanos.
Estos resultados sugieren que la absorción de rosiglitazona oral no se altera en condiciones acompañadas de aumentos en el pH gastrointestinal.
parte superior
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis:
Se realizó un estudio de carcinogenicidad de 2 años en ratones Charles River CD-1 a dosis de 0.4, 1.5 y 6 mg / kg / día en la dieta (dosis más alta equivalente a aproximadamente 12 veces el AUC humano al máximo humano recomendado diariamente dosis). Las ratas Sprague-Dawley se dosificaron durante 2 años mediante sonda oral a dosis de 0,05, 0,3 y 2 mg / kg / día (dosis equivalente más alta a aproximadamente 10 y 20 veces el AUC humano a la dosis diaria máxima recomendada para ratas machos y hembras, respectivamente).
La rosiglitazona no fue cancerígena en el ratón. Hubo un aumento en la incidencia de hiperplasia adiposa en el ratón a dosis de 1.5 mg / kg / día (aproximadamente 2 veces el AUC humano a la dosis diaria máxima recomendada en humanos). En ratas, hubo un aumento significativo en la incidencia de tumores benignos de tejido adiposo (lipomas) a dosis de 0.3 mg / kg / día (aproximadamente 2 veces el AUC humano a la dosis diaria máxima recomendada en humanos). Estos cambios proliferativos en ambas especies se consideran debido a la sobreestimulación farmacológica persistente del tejido adiposo.
Mutagénesis:
La rosiglitazona no fue mutagénica ni clastogénica en los ensayos bacterianos in vitro para la mutación genética, la in vitro prueba de aberración cromosómica en linfocitos humanos, prueba de micronúcleo de ratón in vivo y UDS de rata in vivo / in vitro ensayo. Hubo un pequeño aumento (aproximadamente 2 veces) en la mutación en el ensayo de linfoma de ratón in vitro en presencia de activación metabólica.
Deterioro de la fertilidad:
La rosiglitazona no tuvo efectos sobre el apareamiento o la fertilidad de las ratas machos que recibieron hasta 40 mg / kg / día (aproximadamente 116 veces el AUC humano a la dosis diaria máxima recomendada para humanos). La rosiglitazona alteró la ciclicidad del estro (2 mg / kg / día) y redujo la fertilidad (40 mg / kg / día) de ratas hembras en asociación con niveles más bajos niveles plasmáticos de progesterona y estradiol (aproximadamente 20 y 200 veces el AUC humano a la dosis diaria máxima recomendada en humanos, respectivamente). No se observaron tales efectos a 0.2 mg / kg / día (aproximadamente 3 veces el AUC humano a la dosis diaria máxima recomendada en humanos). En ratas juveniles que recibieron dosis desde los 27 días de edad hasta la madurez sexual (hasta 40 mg / kg / día), no hubo ningún efecto sobre el rendimiento reproductivo masculino, o sobre ciclicidad del estro, rendimiento de apareamiento o incidencia de embarazo en hembras (aproximadamente 68 veces el AUC humano al máximo humano recomendado diariamente dosis). En monos, rosiglitazona (0.6 y 4.6 mg / kg / día; aproximadamente 3 y 15 veces el AUC humano a la dosis diaria humana máxima recomendada, respectivamente) disminuyó el aumento de la fase folicular en estradiol sérico con reducción consecuente en el aumento de la hormona luteinizante, niveles más bajos de progesterona en la fase lútea y amenorrea El mecanismo para estos efectos parece ser la inhibición directa de la esteroidogénesis ovárica.
Toxicología animal
El peso del corazón aumentó en ratones (3 mg / kg / día), ratas (5 mg / kg / día) y perros (2 mg / kg / día) con rosiglitazona tratamientos (aproximadamente 5, 22 y 2 veces el AUC humano a la dosis diaria máxima recomendada en humanos, respectivamente). Los efectos en ratas juveniles fueron consistentes con los observados en adultos. La medición morfométrica indicó que había hipertrofia en los tejidos ventriculares cardíacos, lo que puede deberse al aumento del trabajo cardíaco como resultado de la expansión del volumen plasmático.
parte superior
Estudios clínicos
Monoterapia
En estudios clínicos, el tratamiento con AVANDIA resultó en una mejora en el control glucémico, medido por FPG y HbA1c, con una reducción concurrente de insulina y péptido C. La glucosa y la insulina posprandiales también se redujeron. Esto es consistente con el mecanismo de acción de AVANDIA como sensibilizador a la insulina.
La dosis diaria máxima recomendada es de 8 mg. Los estudios de rango de dosis sugirieron que no se obtuvieron beneficios adicionales con una dosis diaria total de 12 mg.
Estudios clínicos a corto plazo: Un total de 2,315 pacientes con diabetes tipo 2, previamente tratados con dieta sola o medicamentos antidiabéticos, fueron tratados con AVANDIA como monoterapia en 6 doble ciego estudios, que incluyeron dos estudios controlados con placebo de 26 semanas, un estudio controlado con gliburida de 52 semanas y 3 estudios con dosis controladas con placebo de 8 a 12 semanas de duración. Los medicamentos antidiabéticos anteriores se retiraron y los pacientes ingresaron a un período de preinclusión con placebo de 2 a 4 semanas antes de la aleatorización.
Dos ensayos de 26 semanas, doble ciego, controlados con placebo, en pacientes con diabetes tipo 2 (n = 1,401) con glucemia inadecuada control (media basal FPG aproximadamente 228 mg / dL [101 a 425 mg / dL] y media basal HbA1c 8.9% [5.2% a 16.2%]), fueron realizado. El tratamiento con AVANDIA produjo mejoras estadísticamente significativas en FPG y HbA1c en comparación con el valor basal y en relación con el placebo. Los datos de uno de estos estudios se resumen en la Tabla 9.
Tabla 9: Parámetros glucémicos en un ensayo controlado con placebo de 26 semanas
| Placebo N = 173 |
AVANDIA | AVANDIA | |||
| 4 mg una vez al día N = 180 |
2 mg dos veces al día N = 186 |
8 mg una vez al día N = 181 |
4 mg dos veces al día N = 187 |
||
| FPG (mg / dL) | |||||
| Línea de base (media) | 225 | 229 | 225 | 228 | 228 |
| Cambio desde el inicio (media) | 8 | -25 | -35 | -42 | -55 |
| Diferencia con placebo (media ajustada) | - | -31* | -43* | -49* | -62* |
| El% de pacientes con disminución de ¥ 30 mg / dL desde el inicio | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Línea de base (media) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Cambio desde el inicio (media) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Diferencia con placebo (media ajustada) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % de pacientes con â â ¥ 0.7% de disminución desde el inicio | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 en comparación con placebo. |
Cuando se administró a la misma dosis diaria total, AVANDIA fue generalmente más eficaz en la reducción de FPG y HbA1c cuando se administró en dosis divididas dos veces al día en comparación con las dosis de una vez al día. Sin embargo, para HbA1c, la diferencia entre las dosis de 4 mg una vez al día y 2 mg dos veces al día no fue estadísticamente significativa.
Estudios clínicos a largo plazo
El mantenimiento a largo plazo del efecto se evaluó en un ensayo doble ciego controlado con gliburida de 52 semanas en pacientes con diabetes tipo 2. Los pacientes fueron asignados al azar al tratamiento con AVANDIA 2 mg dos veces al día (N = 195) o AVANDIA 4 mg dos veces al día (N = 189) o gliburida (N = 202) durante 52 semanas. Los pacientes que recibieron gliburida recibieron una dosis inicial de 2.5 mg / día o 5.0 mg / día. La dosis se tituló en incrementos de 2.5 mg / día durante las siguientes 12 semanas, hasta una dosis máxima de 15.0 mg / día para optimizar el control glucémico. Posteriormente, la dosis de gliburida se mantuvo constante.
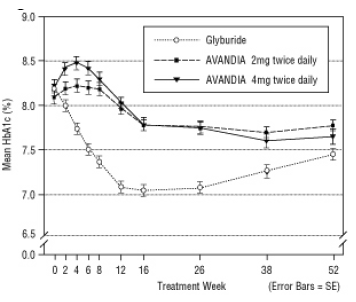
La mediana de la dosis titulada de gliburida fue de 7,5 mg. Todos los tratamientos resultaron en una mejora estadísticamente significativa en el control glucémico desde el inicio (Figura 4 y Figura 5). Al final de la semana 52, la reducción del valor basal en FPG y HbA1c fue de -40.8 mg / dL y -0.53% con AVANDIA 4 mg dos veces al día; -25.4 mg / dL y -0.27% con AVANDIA 2 mg dos veces al día; y -30.0 mg / dL y -0.72% con gliburida. Para HbA1c, la diferencia entre AVANDIA 4 mg dos veces al día y gliburida no fue estadísticamente significativa en la semana 52. La caída inicial de FPG con gliburida fue mayor que con AVANDIA; sin embargo, este efecto fue menos duradero en el tiempo.
La mejora en el control glucémico observada con AVANDIA 4 mg dos veces al día en la semana 26 se mantuvo hasta la semana 52 del estudio.
Figura 4. Promedio de FPG a lo largo del tiempo en un estudio controlado de gliburida de 52 semanas
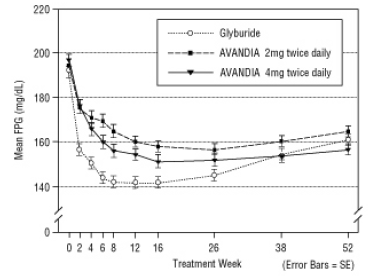
Figura 5. HbA1c media a lo largo del tiempo en un estudio controlado con gliburida de 52 semanas
Se notificó hipoglucemia en el 12,1% de los pacientes tratados con gliburida versus el 0,5% (2 mg dos veces al día) y el 1,6% (4 mg dos veces al día) de los pacientes tratados con AVANDIA. Las mejoras en el control glucémico se asociaron con un aumento de peso medio de 1.75 kg y 2.95 kg para pacientes tratados con 2 mg y 4 mg dos veces al día de AVANDIA, respectivamente, versus 1.9 kg en pacientes tratados con gliburida pacientes En pacientes tratados con AVANDIA, se dividieron productos de péptido C, insulina, proinsulina y proinsulina. significativamente reducido de una manera ordenada por dosis, en comparación con un aumento en el tratamiento con gliburida pacientes
Un ensayo de progresión de resultados de diabetes (ADOPT) fue un ensayo multicéntrico, doble ciego y controlado (N = 4,351) realizado durante 4 a 6 años para comparar la seguridad y la eficacia de AVANDIA, metformina y monoterapia con gliburida en pacientes recientemente diagnosticados con diabetes mellitus tipo 2 (â ‰ ¤ 3 años) inadecuadamente controlados con dieta y ejercicio. La edad media de los pacientes en este ensayo fue de 57 años y la mayoría de los pacientes (83%) no tenían antecedentes conocidos de enfermedad cardiovascular. La media basal de FPG y HbA1c fueron 152 mg / dL y 7.4%, respectivamente. Los pacientes fueron aleatorizados para recibir AVANDIA 4 mg una vez al día, gliburida 2.5 mg una vez al día o metformina 500 mg una vez al día, y las dosis fueron titulado para un control glucémico óptimo hasta un máximo de 4 mg dos veces al día para AVANDIA, 7.5 mg dos veces al día para gliburida y 1,000 mg dos veces al día para metformina El resultado primario de eficacia fue el tiempo hasta FPG consecutivos> 180 mg / dL después de al menos 6 semanas de tratamiento como máximo dosis tolerada de medicación del estudio o tiempo hasta el control glucémico inadecuado, según lo determine una adjudicación independiente comité.
La incidencia acumulada del resultado primario de eficacia a los 5 años fue del 15% con AVANDIA, del 21% con metformina y del 34% con gliburida (cociente de riesgos 0,68 [IC 95% 0,55, 0,85] versus metformina, HR 0,37 [IC 95% 0,30, 0,45] versus gliburida).
Los datos sobre eventos cardiovasculares y adversos (incluidos los efectos sobre el peso corporal y la fractura ósea) de ADOPT para AVANDIA, metformina y gliburida se describen en ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS, respectivamente. Al igual que con todos los medicamentos, los resultados de eficacia deben considerarse junto con la información de seguridad para evaluar el beneficio potencial y el riesgo para un paciente individual.
Combinación con metformina o sulfonilurea
La adición de AVANDIA a metformina o sulfonilurea resultó en reducciones significativas en la hiperglucemia en comparación con cualquiera de estos agentes solos. Estos resultados son consistentes con un efecto aditivo en el control glucémico cuando AVANDIA se usa como terapia combinada.
Combinación con metformina
Un total de 670 pacientes con diabetes tipo 2 participaron en dos 26 semanas, aleatorizado, doble ciego, estudios controlados con placebo / activo diseñados para evaluar la eficacia de AVANDIA en combinación con metformina AVANDIA, administrado en regímenes de dosificación una vez al día o dos veces al día, se agregó a la terapia de pacientes que no se controlaron adecuadamente con una dosis máxima (2,5 gramos / día) de metformina.
En un estudio, los pacientes controlaron de manera inadecuada 2.5 met / min de metformina (valor basal promedio FPG 216 mg / dL y valor basal promedio HbA1c 8.8%) fueron aleatorizados para recibir 4 mg de AVANDIA una vez al día, 8 mg de AVANDIA una vez al día o placebo además de metformina Se observó una mejora estadísticamente significativa en FPG y HbA1c en pacientes tratados con las combinaciones de metformina y 4 mg de AVANDIA una vez al día y 8 mg de AVANDIA una vez al día, en comparación con los pacientes que continuaron con metformina sola (Tabla 10).
Tabla 10. Parámetros glucémicos en un estudio combinado de 26 semanas de metformina AVANDIA Plus
| Metformina N = 113 |
AVANDIA 4 mg una vez al día + metformina N = 116 |
AVANDIA 8 mg una vez al día + metformina N = 110 |
|
| FPG (mg / dL) | |||
| Línea de base (media) | 214 | 215 | 220 |
| Cambio desde el inicio (media) | 6 | -33 | -48 |
| Diferencia con metformina sola (media ajustada) | - | -40* | -53* |
| El% de pacientes con disminución de ¥ 30 mg / dL desde el inicio | 20% | 45% | 61% |
| HbA1c (%) | |||
| Línea de base (media) | 8.6 | 8.9 | 8.9 |
| Cambio desde el inicio (media) | 0.5 | -0.6 | -0.8 |
| Diferencia con metformina sola (media ajustada) | - | -1.0* | -1.2* |
| % de pacientes con â â ¥ 0.7% de disminución desde el inicio | 11% | 45% | 52% |
| * p <0,0001 en comparación con metformina. |
En un segundo estudio de 26 semanas, los pacientes con diabetes tipo 2 controlaron inadecuadamente 2.5 gramos / día de metformina que fueron asignados al azar para recibir la combinación de AVANDIA 4 mg dos veces al día y La metformina (N = 105) mostró una mejora estadísticamente significativa en el control glucémico con un efecto de tratamiento promedio para FPG de -56 mg / dL y un efecto de tratamiento promedio para HbA1c de -0.8% sobre metformina sola La combinación de metformina y AVANDIA resultó en niveles más bajos de FPG y HbA1c que cualquiera de los agentes solos.
Pacientes que no fueron controlados adecuadamente con una dosis máxima (2,5 gramos / día) de metformina y que fueron cambiado a monoterapia con AVANDIA demostró pérdida de control glucémico, como lo demuestran los aumentos en FPG y HbA1c. En este grupo, también se observaron aumentos en LDL y VLDL.
Combinación con una sulfonilurea
Un total de 3.457 pacientes con diabetes tipo 2 participaron en diez estudios aleatorizados, doble ciego, controlados con placebo / activo de 24 a 26 semanas y uno Estudio doble ciego de 2 años con control activo en pacientes de edad avanzada diseñado para evaluar la eficacia y seguridad de AVANDIA en combinación con un sulfonilurea Se administró AVANDIA 2 mg, 4 mg u 8 mg al día, ya sea una vez al día (3 estudios) o en dosis divididas dos veces al día (7 estudios), a pacientes controlados inadecuadamente con una dosis submáxima o máxima de sulfonilurea
En estos estudios, la combinación de AVANDIA 4 mg u 8 mg diarios (administrados como dosis divididas únicas o dos veces al día) y un La sulfonilurea redujo significativamente la FPG y la HbA1c en comparación con el placebo más sulfonilurea o una mayor titulación del sulfonilurea La Tabla 11 muestra los datos agrupados para 8 estudios en los que AVANDIA agregado a sulfonilurea se comparó con placebo más sulfonilurea.
Tabla 11. Parámetros glucémicos en estudios combinados de 24 a 26 semanas de AVANDIA Plus Sulfonilurea
| Dosificación dividida dos veces al día (5 estudios) | Sulfonilurea N = 397 |
AVANDIA 2 mg dos veces al día + sulfonilurea N = 497 |
Sulfonilurea N = 248 |
AVANDIA 4 mg dos veces al día + sulfonilurea N = 346 |
| FPG (mg / dL) | ||||
| Línea de base (media) | 204 | 198 | 188 | 187 |
| Cambio desde el inicio (media) | 11 | -29 | 8 | -43 |
| Diferencia de sulfonilurea sola (media ajustada) | - | -42* | - | -53* |
| El% de pacientes con disminución de ¥ 30 mg / dL desde el inicio | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Línea de base (media) | 9.4 | 9.5 | 9.3 | 9.6 |
| Cambio desde el inicio (media) | 0.2 | -1.0 | 0.0 | -1.6 |
| Diferencia de sulfonilurea sola (media ajustada) | - | -1.1* | - | -1.4* |
| % de pacientes con â â ¥ 0.7% de disminución desde el inicio | 21% | 60% | 23% | 75% |
| Dosificación una vez al día (3 estudios) | Sulfonilurea N = 172 |
AVANDIA 4 mg una vez al día + sulfonilurea N = 172 |
Sulfonilurea N = 173 |
AVANDIA 8 mg una vez al día + sulfonilurea N = 176 |
| FPG (mg / dL) | ||||
| Línea de base (media) | 198 | 206 | 188 | 192 |
| Cambio desde el inicio (media) | 17 | -25 | 17 | -43 |
| Diferencia de sulfonilurea sola (media ajustada) | - | -47* | - | -66* |
| El% de pacientes con disminución de ¥ 30 mg / dL desde el inicio | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Línea de base (media) | 8.6 | 8.8 | 8.9 | 8.9 |
| Cambio desde el inicio (media) | 0.4 | -0.5 | 0.1 | -1.2 |
| Diferencia de sulfonilurea sola (media ajustada) | - | -0.9* | - | -1.4* |
| % de pacientes con â â ¥ 0.7% de disminución desde el inicio | 11% | 36% | 20% | 68% |
| * p <0,0001 en comparación con sulfonilurea sola. |
Uno de los estudios de 24 a 26 semanas incluyó pacientes que no estaban controlados adecuadamente con las dosis máximas de gliburida y cambiaron a 4 mg de AVANDIA diariamente como monoterapia; en este grupo, se demostró la pérdida de control glucémico, como lo demuestran los aumentos en FPG y HbA1c.
En un estudio doble ciego de 2 años, los pacientes de edad avanzada (de 59 a 89 años) con sulfonilurea semimáxima (glipizida 10 mg dos veces al día) fueron asignados al azar a la adición de AVANDIA (n = 115, 4 mg una vez al día a 8 mg según sea necesario) o la titulación continua de glipizida (n = 110), hasta un máximo de 20 mg dos veces diario. La media de la línea de base FPG y HbA1c fueron 157 mg / dL y 7.72%, respectivamente, para el brazo AVANDIA plus glipizida y 159 mg / dL y 7.65%, respectivamente, para el brazo de titulación ascendente de glipizida. La pérdida de control glucémico (FPG â ‰ ¥ 180 mg / dL) ocurrió en una proporción significativamente menor de pacientes (2%) en AVANDIA más glipizida en comparación con los pacientes en el grupo de titulación ascendente de glipizida (28.7%). Alrededor del 78% de los pacientes en terapia combinada completaron los 2 años de terapia, mientras que solo el 51% completó la monoterapia con glipizida. El efecto de la terapia de combinación sobre FPG y HbA1c fue duradero durante el período de estudio de 2 años, con pacientes lograr una media de 132 mg / dL para FPG y una media de 6.98% para HbA1c en comparación con ningún cambio en la glipizida brazo.
Combinación con sulfonilurea más metformina
En dos estudios de 24 a 26 semanas, doble ciego, controlados con placebo, diseñados para evaluar la eficacia y seguridad de AVANDIA en combinación con sulfonilurea más metformina, AVANDIA 4 mg u 8 mg diariamente, se administró en dosis divididas dos veces al día, a pacientes controlados inadecuadamente con dosis submáxima (10 mg) y máxima (20 mg) de gliburida y dosis máxima de metformina (2) g / día). Se observó una mejora estadísticamente significativa en FPG y HbA1c en pacientes tratados con las combinaciones de sulfonilurea más metformina y 4 mg de AVANDIA y 8 mg de AVANDIA versus pacientes continuaron con sulfonilurea más metformina, como se muestra en la Tabla 12.
Tabla 12. Parámetros glucémicos en un estudio combinado de 26 semanas de AVANDIA Plus Sulfonylurea and Metformin
| Sulfonilurea + metformina N = 273 |
AVANDIA 2 mg dos veces diariamente + sulfonilurea + metformina N = 276 |
AVANDIA 4 mg dos veces al día + sulfonilurea + metformina N = 277 |
|
| FPG (mg / dL) | |||
| Línea de base (media) | 189 | 190 | 192 |
| Cambio desde el inicio (media) | 14 | -19 | -40 |
| Diferencia de sulfonilurea más metformina (media ajustada) | - | -30* | -52* |
| El% de pacientes con disminución de ¥ 30 mg / dL desde el inicio | 16% | 46% | 62% |
| HbA1c (%) | |||
| Línea de base (media) | 8.7 | 8.6 | 8.7 |
| Cambio desde el inicio (media) | 0.2 | -0.4 | -0.9 |
| Diferencia de sulfonilurea más metformina (media ajustada) | - | -0.6* | -1.1* |
| % de pacientes con â â ¥ 0.7% de disminución desde el inicio | 16% | 39% | 63% |
| * p <0,0001 en comparación con placebo. |
parte superior
Referencias
- Documento informativo de la Administración de Alimentos y Medicamentos. Reunión conjunta de los Comités Asesores de Drogas Metabólicas Endocrino y Seguridad de Drogas y Gestión de Riesgos Ju 2007.
- DREAM Investigadores de prueba. Efecto de rosiglitazone en la frecuencia de diabetes con intolerancia a la glucosa o alteración de la glucosa en ayunas: un control aleatorio Lanceta 2006;368:1096-1105.
- Home PD, Pocock SJ, Beck-Nielsen H, et al. Rosiglitazone evaluó los resultados de cardiovas, un análisis intermedio. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH, et al. Efecto de la rifampicina sobre la farmacocinética de rosiglitazona en sujetos sanos. Clin Pharmacol Ther 2004; 75: 157-162.
parte superior
Cómo se suministra / Almacenamiento y manipulación
Cada tableta TILTAB recubierta con película pentagonal contiene rosiglitazona como maleato de la siguiente manera: 2 mg de rosa, grabado con SB en un lado y 2 en el otro; 4 mg de naranja, grabada con SB en un lado y 4 en el otro; 8 mg-rojo-marrón, grabado con SB en un lado y 8 en el otro.
- Frascos de 2 mg de 60: NDC 0029-3158-18
- Frascos de 4 mg de 30: NDC 0029-3159-13
- Frascos de 4 mg de 90: NDC 0029-3159-00
- Botellas de 8 mg de 30: NDC 0029-3160-13
- Botellas de 8 mg de 90: NDC 0029-3160-59
Almacenar a 25 C (77 ° F); excursiones de 15 a 30 C (59 a 86 F). Dispensar en un recipiente hermético y resistente a la luz.
última actualización 02/2008
Avandia, maleato de rosiglitazona, información para el paciente (en inglés simple)
Información detallada sobre signos, síntomas, causas, tratamientos de diabetes
La información de esta monografía no pretende abarcar todos los usos, instrucciones, precauciones, interacciones farmacológicas o efectos adversos posibles. Esta información es generalizada y no pretende ser un consejo médico específico. Si tiene preguntas sobre los medicamentos que está tomando o desea obtener más información, consulte con su médico, farmacéutico o enfermero.
de regreso:Ver todos los medicamentos para la diabetes

