Janumet para el tratamiento de la diabetes
Nombre de la marca: Janumet
Nombre genérico: clorhidrato de sitagliptina y metformina
Contenido:
Indicaciones y uso
Dosificación y administración
Formas de dosificación y fortalezas
Contraindicaciones
Advertencias y precauciones
Reacciones adversas
Interacciones con la drogas
Uso en poblaciones específicas
Sobredosis
Descripción
Farmacología
Toxicología no clínica
Estudios clínicos
Cómo suministrado
Información de asesoramiento para pacientes
Janumet, clorhidrato de sitagliptina y metformina, información para el paciente (en inglés simple)
ADVERTENCIA: ACIDOSIS LÁCTICA
La acidosis láctica es una complicación rara pero grave que puede ocurrir debido a la acumulación de metformina. El riesgo aumenta con afecciones como sepsis, deshidratación, consumo excesivo de alcohol, insuficiencia hepática, insuficiencia renal e insuficiencia cardíaca congestiva aguda.
El inicio suele ser sutil, acompañado solo de síntomas inespecíficos como malestar general, mialgias, dificultad respiratoria, aumento de la somnolencia y dificultad abdominal inespecífica. Las anormalidades de laboratorio incluyen pH bajo, aumento de la brecha aniónica y aumento de lactato en sangre.
Si se sospecha acidosis, Janumet1 debe suspenderse y el paciente debe ser hospitalizado de inmediato. [Ver Advertencias y precauciones]
Indicaciones y uso
Janumet está indicado como un complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2 cuando el tratamiento con sitagliptina y metformina es apropiado. [Ver Estudios clínicos.]
Limitaciones importantes de uso
Janumet no debe usarse en pacientes con diabetes tipo 1 o para el tratamiento de la cetoacidosis diabética, ya que no sería eficaz en estos entornos.
Janumet no se ha estudiado en combinación con insulina.
parte superior
Dosificación y administración
Dosis recomendada
La dosificación de la terapia antihiperglucémica con Janumet debe individualizarse en función del régimen actual del paciente. efectividad y tolerabilidad sin exceder la dosis diaria máxima recomendada de 100 mg de sitagliptina y 2000 mg metformina La terapia de combinación inicial o el mantenimiento de la terapia de combinación se deben individualizar y dejar a discreción del proveedor de atención médica.
Janumet generalmente se debe administrar dos veces al día con las comidas, con un aumento gradual de la dosis, para reducir los efectos secundarios gastrointestinales (GI) debidos a la metformina.
La dosis inicial de Janumet debe basarse en el régimen actual del paciente. Janumet debe administrarse dos veces al día con las comidas. Las siguientes dosis están disponibles:
50 mg de sitagliptina / 500 mg de hidrocloruro de metformina
50 mg de sitagliptina / 1000 mg de hidrocloruro de metformina.
Pacientes controlados inadecuadamente con dieta y ejercicio solo
Si la terapia con una tableta combinada que contiene sitagliptina y metformina se considera apropiada para un paciente con diabetes mellitus tipo 2 controlada inadecuadamente con dieta y ejercicio solo, la dosis inicial recomendada es 50 mg de sitagliptina / 500 mg de hidrocloruro de metformina dos veces diario. Los pacientes con control glucémico inadecuado con esta dosis pueden titularse hasta 50 mg de sitagliptina / 1000 mg de hidrocloruro de metformina dos veces al día.
Pacientes controlados inadecuadamente con monoterapia con metformina
Si la terapia con una tableta combinada que contiene sitagliptina y metformina se considera apropiada para un paciente controlado inadecuadamente con metformina sola, el la dosis inicial recomendada de Janumet debe proporcionar sitagliptina dosificada como 50 mg dos veces al día (dosis diaria total de 100 mg) y la dosis de metformina ya está siendo tomado. Para los pacientes que toman metformina 850 mg dos veces al día, la dosis inicial recomendada de Janumet es 50 mg de sitagliptina / 1000 mg de hidrocloruro de metformina dos veces al día.
Pacientes controlados inadecuadamente con monoterapia con sitagliptina
Si la terapia con una tableta combinada que contiene sitagliptina y metformina se considera inadecuada para un paciente de manera inadecuada controlado con sitagliptina sola, la dosis inicial recomendada de Janumet es 50 mg de sitagliptina / 500 mg de hidrocloruro de metformina dos veces diario. Los pacientes con un control inadecuado de esta dosis pueden titularse hasta 50 mg de sitagliptina / 1000 mg de hidrocloruro de metformina dos veces al día. Los pacientes que toman monoterapia con sitagliptina ajustada a la dosis para insuficiencia renal no deben cambiarse a Janumet [ver Contraindicaciones].
Pacientes que cambian de la administración conjunta de sitagliptina y metformina
Para los pacientes que cambian de sitagliptina administrada conjuntamente con metformina, Janumet puede iniciarse con la dosis de sitagliptina y metformina que ya se está tomando.
Pacientes controlados inadecuadamente con terapia de combinación dual con cualquiera de los dos agentes antihiperglucémicos siguientes: sitagliptina, metformina o una sulfonilurea
Si la terapia con una tableta combinada que contiene sitagliptina y metformina se considera apropiada en este, la dosis inicial habitual de Janumet debe proporcionar sitagliptina en dosis de 50 mg dos veces al día (100 mg en total dosis diaria). Al determinar la dosis inicial del componente de metformina, se debe considerar el nivel de control glucémico del paciente y la dosis actual (si la hay) de metformina. Se debe considerar un aumento gradual de la dosis para reducir los efectos secundarios gastrointestinales (GI) asociados con la metformina. Los pacientes que actualmente reciben o inician una sulfonilurea pueden requerir dosis más bajas de sulfonilurea para reducir el riesgo de hipoglucemia [ver Advertencias y precauciones].
No se han realizado estudios que examinen específicamente la seguridad y la eficacia de Janumet en pacientes previamente tratados con otros agentes antihiperglucémicos orales y que hayan cambiado a Janumet. Cualquier cambio en la terapia de la diabetes tipo 2 debe llevarse a cabo con cuidado y un control adecuado, ya que pueden ocurrir cambios en el control glucémico.
parte superior
Formas de dosificación y fortalezas
- Los comprimidos de 50 mg / 500 mg son comprimidos recubiertos con película de color rosa claro, con forma de cápsula, con "575" grabados en un lado.
- Los comprimidos de 50 mg / 1000 mg son comprimidos rojos, con forma de cápsula, recubiertos con película con "577" grabados en un lado.
parte superior
Contraindicaciones
Janumet (sitagliptina / metformina HCl) está contraindicado en pacientes con:
- Enfermedad renal o disfunción renal, por ejemplo, según lo sugerido por los niveles de creatinina sérica â ‰ ¥ 1.5 mg / dL [hombres], â ‰ ¥ 1.4 mg / dL [mujeres] o anormal aclaramiento de creatinina que también puede resultar de afecciones como colapso cardiovascular (shock), infarto agudo de miocardio y septicemia [ver Advertencias y precauciones].
- Acidosis metabólica aguda o crónica, incluida la cetoacidosis diabética, con o sin coma.
- Antecedentes de una reacción de hipersensibilidad grave a Janumet o sitagliptina (uno de los componentes de Janumet), como anafilaxia o angioedema. [Ver Advertencias y precauciones y Reacciones adversas.]
Janumet debe suspenderse temporalmente en pacientes sometidos a estudios radiológicos que involucren intravascular administración de materiales de contraste yodados, porque el uso de tales productos puede provocar una alteración aguda de la función renal. función [ver Advertencias y precauciones].
parte superior
Advertencias y precauciones
Acidosis láctica
Clorhidrato de metformina
La acidosis láctica es una complicación metabólica rara pero grave que puede ocurrir debido a la acumulación de metformina durante el tratamiento con Janumet; cuando ocurre, es fatal en aproximadamente el 50% de los casos. La acidosis láctica también puede ocurrir en asociación con una serie de afecciones fisiopatológicas, incluida la diabetes mellitus, y siempre que haya hipoperfusión e hipoxemia tisular significativas. La acidosis láctica se caracteriza por niveles elevados de lactato en sangre (> 5 mmol / L), disminución del pH de la sangre, alteraciones electrolíticas con un aumento de la brecha aniónica y una mayor relación lactato / piruvato. Cuando metformina está implicada como la causa de la acidosis láctica, generalmente se encuentran niveles plasmáticos de metformina> 5 μg / ml.
La incidencia reportada de acidosis láctica en pacientes que reciben clorhidrato de metformina es muy baja. (aproximadamente 0.03 casos / 1000 pacientes-año, con aproximadamente 0.015 casos fatales / 1000 paciente-años). En más de 20,000 pacientes-años de exposición a metformina en ensayos clínicos, no hubo informes de acidosis láctica. Los casos informados se han producido principalmente en pacientes diabéticos con insuficiencia renal significativa, incluidos los dos riñones intrínsecos. enfermedad e hipoperfusión renal, a menudo en el contexto de múltiples problemas médicos / quirúrgicos concomitantes y concomitantes múltiples medicamentos Pacientes con insuficiencia cardíaca congestiva que requieren tratamiento farmacológico, en particular aquellos con inestabilidad o La insuficiencia cardíaca congestiva aguda que están en riesgo de hipoperfusión e hipoxemia, tienen un mayor riesgo de láctica acidosis. El riesgo de acidosis láctica aumenta con el grado de disfunción renal y la edad del paciente. El riesgo de acidosis láctica puede, por lo tanto, disminuir significativamente mediante el monitoreo regular de la función renal en pacientes que toman metformina y mediante el uso de la dosis mínima efectiva de metformina. En particular, el tratamiento de los ancianos debe ir acompañado de un control cuidadoso de la función renal. El tratamiento con metformina no debe iniciarse en pacientes de ¥ 80 años de edad a menos que se mida el aclaramiento de creatinina demuestra que la función renal no se reduce, ya que estos pacientes son más susceptibles a desarrollar acidosis láctica. Además, la metformina debe suspenderse rápidamente en presencia de cualquier afección asociada con hipoxemia, deshidratación o sepsis. Debido a que la función hepática deteriorada puede limitar significativamente la capacidad de eliminar el lactato, generalmente se debe evitar la metformina en pacientes con evidencia clínica o de laboratorio de enfermedad hepática. Se debe advertir a los pacientes contra el consumo excesivo de alcohol, ya sea agudo o crónico, cuando toman metformina, ya que el alcohol potencia los efectos del clorhidrato de metformina en el metabolismo del lactato. Además, la metformina debe suspenderse temporalmente antes de cualquier estudio de contraste radiológico intravascular y para cualquier procedimiento quirúrgico [ver Advertencias y precauciones].
El inicio de la acidosis láctica a menudo es sutil y se acompaña solo de síntomas inespecíficos como malestar general, mialgias, dificultad respiratoria, aumento de la somnolencia y angustia abdominal inespecífica. Puede haber hipotermia, hipotensión y bradiarritmias resistentes asociadas con acidosis más marcada. El paciente y el médico del paciente deben ser conscientes de la posible importancia de tales síntomas y se debe indicar al paciente que notifique al médico de inmediato si se presentan [consulte Advertencias y precauciones]. La metformina debe retirarse hasta que se aclare la situación. Los electrolitos séricos, las cetonas, la glucosa en sangre y, si está indicado, el pH de la sangre, los niveles de lactato e incluso los niveles de metformina en sangre pueden ser útiles. Una vez que un paciente se estabiliza con cualquier nivel de dosis de metformina, es poco probable que los síntomas gastrointestinales, que son comunes durante el inicio de la terapia, estén relacionados con el medicamento. La aparición posterior de síntomas gastrointestinales podría deberse a acidosis láctica u otra enfermedad grave.
Los niveles de lactato plasmático venoso en ayunas por encima del límite superior de lo normal pero inferior a 5 mmol / L en pacientes que toman metformina no necesariamente indican una inminente actividad láctica. acidosis y puede explicarse por otros mecanismos, como diabetes u obesidad mal controlada, actividad física vigorosa o problemas técnicos en el manejo de muestras [ver Advertencias y precauciones].
Se debe sospechar acidosis láctica en cualquier paciente diabético con acidosis metabólica que no tenga evidencia de cetoacidosis (cetonuria y cetonemia).
La acidosis láctica es una emergencia médica que debe tratarse en un hospital. En un paciente con acidosis láctica que está tomando metformina, el medicamento debe suspenderse de inmediato y se deben establecer medidas de apoyo generales de inmediato. Porque el clorhidrato de metformina es dializable (con un aclaramiento de hasta 170 ml / min bajo buena hemodinámica condiciones), se recomienda la hemodiálisis inmediata para corregir la acidosis y eliminar la acumulación metformina Tal manejo a menudo resulta en la reversión inmediata de los síntomas y la recuperación [ver Contraindicaciones; Advertencias y precauciones].
Función hepática deteriorada
Dado que la función hepática deteriorada se ha asociado con algunos casos de acidosis láctica, Janumet generalmente debe evitarse en pacientes con evidencia clínica o de laboratorio de enfermedad hepática.
Valoración de la función renal
Se sabe que la metformina y la sitagliptina se excretan sustancialmente por el riñón. El riesgo de acumulación de metformina y acidosis láctica aumenta con el grado de deterioro de la función renal. Por lo tanto, los pacientes con niveles de creatinina sérica por encima del límite superior de lo normal para su edad no deben recibir Janumet. En los ancianos, Janumet debe ajustarse cuidadosamente para establecer la dosis mínima para un efecto glucémico adecuado, ya que el envejecimiento puede estar asociado con una función renal reducida. [Ver Advertencias y precauciones y Uso en poblaciones específicas.]
Antes del inicio de la terapia con Janumet y al menos una vez al año a partir de entonces, la función renal debe evaluarse y verificarse como normal. En pacientes en los que se anticipa el desarrollo de disfunción renal, particularmente en pacientes de edad avanzada, renal la función debe evaluarse con mayor frecuencia y Janumet debe suspenderse si hay evidencia de insuficiencia renal presente.
Vitamina B12 Niveles
En ensayos clínicos controlados de metformina de 29 semanas de duración, una disminución a niveles subnormales de vitamina B sérica previamente normal12 niveles, sin manifestaciones clínicas, se observó en aproximadamente el 7% de los pacientes. Tal disminución, posiblemente debido a la interferencia con B12 absorción de la B12complejo intrínseco al factor, sin embargo, rara vez se asocia con anemia y parece ser rápidamente reversible con la interrupción de metformina o vitamina B12 suplementación Se recomienda medir anualmente los parámetros hematológicos en pacientes con Janumet y cualquier anormalidad aparente debe investigarse y manejarse adecuadamente. [Ver Reacciones adversas.]
Ciertos individuos (aquellos con vitamina B inadecuada12 o la ingesta o absorción de calcio) parecen estar predispuestos a desarrollar vitamina B subnormal12 niveles. En estos pacientes, suero de rutina vitamina B12 Las mediciones a intervalos de dos a tres años pueden ser útiles.
Consumo de alcohol
Se sabe que el alcohol potencia el efecto de la metformina en el metabolismo del lactato. Los pacientes, por lo tanto, deben ser advertidos contra el consumo excesivo de alcohol, agudo o crónico, mientras reciben Janumet.
Procedimientos quirúrgicos
El uso de Janumet debe suspenderse temporalmente para cualquier procedimiento quirúrgico (excepto los procedimientos menores no asociados con la ingesta restringida de alimentos y líquidos) y no debe reiniciarse hasta que se haya reanudado la ingesta oral del paciente y se haya evaluado la función renal como normal.
Cambio en el estado clínico de pacientes con diabetes tipo 2 previamente controlada
Un paciente con diabetes tipo 2 previamente bien controlado en Janumet que desarrolla anormalidades de laboratorio o clínicas la enfermedad (especialmente la enfermedad vaga y mal definida) debe evaluarse de inmediato para detectar evidencia de cetoacidosis o láctica acidosis. La evaluación debe incluir electrolitos séricos y cetonas, glucosa en sangre y, si está indicado, niveles de pH, lactato, piruvato y metformina en sangre. Si se produce acidosis de cualquier forma, Janumet debe detenerse de inmediato y deben iniciarse otras medidas correctivas apropiadas.
Usar con medicamentos conocidos por causar hipoglucemia
Sitagliptina
Como es típico con otros agentes antihiperglucémicos usados en combinación con una sulfonilurea, cuando se usó sitagliptina en combinación con metformina y un sulfonilurea, un medicamento conocido por causar hipoglucemia, la incidencia de hipoglucemia se incrementó sobre la de placebo en combinación con metformina y un sulfonilurea [ver Reacciones adversas]. Por lo tanto, los pacientes que también reciben un secretagogo de insulina (p. Ej., Sulfonilurea, meglitinida) pueden requerir una dosis más baja del secretagogo de insulina para reducir el riesgo de hipoglucemia [ver Dosificación y administración].
Clorhidrato de metformina
La hipoglucemia no ocurre en pacientes que reciben metformina sola en circunstancias normales de uso, pero podría ocurrir cuando la ingesta calórica es deficiente, cuando el ejercicio extenuante no se compensa con suplementos calóricos o durante el uso concomitante con otros agentes reductores de la glucosa (como las sulfonilureas y la insulina) o etanol. Los pacientes de edad avanzada, debilitados o desnutridos, y aquellos con insuficiencia suprarrenal o hipofisaria o intoxicación por alcohol son particularmente susceptibles a los efectos hipoglucémicos. La hipoglucemia puede ser difícil de reconocer en los ancianos y en las personas que toman medicamentos bloqueadores adrenérgicos β.
Medicamentos concomitantes que afectan la función renal o la disposición de metformina
Medicamentos concomitantes que pueden afectar la función renal o provocar un cambio hemodinámico significativo o pueden interferir con la disposición de metformina, como los medicamentos catiónicos que se eliminan por secreción tubular renal [ver Interacciones con la drogas], debe usarse con precaución.
Estudios radiológicos con materiales de contraste yodados intravasculares
Estudios de contraste intravascular con materiales yodados (por ejemplo, urograma intravenoso, colangiografía intravenosa, angiografía y tomografía computarizada (TC) con materiales de contraste intravascular) puede conducir a una alteración aguda de la función renal y se han asociado con acidosis láctica en pacientes que reciben metformina [ver Contraindicaciones]. Por lo tanto, en pacientes en los que se planifica dicho estudio, Janumet debe suspenderse temporalmente en el momento o antes de la procedimiento, y retenido durante 48 horas posteriores al procedimiento y reinstituido solo después de que la función renal haya sido reevaluada y se haya encontrado que sé normal.
Estados hipóxicos
Colapso cardiovascular (shock) por cualquier causa, insuficiencia cardíaca congestiva aguda, infarto agudo de miocardio y otras afecciones caracterizadas por hipoxemia se han asociado con acidosis láctica y también pueden causar prerenal azotemia Cuando tales eventos ocurren en pacientes en tratamiento con Janumet, el medicamento debe suspenderse de inmediato.
Pérdida de control de la glucosa en sangre
Cuando un paciente estabilizado en cualquier régimen diabético está expuesto a estrés como fiebre, trauma, infección o cirugía, puede ocurrir una pérdida temporal del control glucémico. En esos momentos, puede ser necesario retener Janumet y administrar temporalmente insulina. Janumet puede reinstituirse después de que se resuelva el episodio agudo.
Reacciones hipersensibles
Ha habido informes posteriores a la comercialización de reacciones de hipersensibilidad graves en pacientes tratados con sitagliptina, uno de los componentes de Janumet. Estas reacciones incluyen anafilaxia, angioedema y afecciones exfoliativas de la piel, incluido el síndrome de Stevens-Johnson. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, generalmente es no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al medicamento. El inicio de estas reacciones ocurrió dentro de los primeros 3 meses después del inicio del tratamiento con sitagliptina, con algunos informes después de la primera dosis. Si se sospecha una reacción de hipersensibilidad, suspenda Janumet, evalúe otras posibles causas del evento e instituya un tratamiento alternativo para la diabetes. [Ver Reacciones adversas.]
Resultados macrovasculares
No se han realizado estudios clínicos que establezcan evidencia concluyente de reducción del riesgo macrovascular con Janumet o cualquier otro medicamento antidiabético.
parte superior
Reacciones adversas
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, se observaron tasas de reacciones adversas en los ensayos clínicos de un el fármaco no puede compararse directamente con las tasas en los ensayos clínicos de otro fármaco y puede no reflejar las tasas observadas en práctica.
Administración conjunta de sitagliptina y metformina en pacientes con diabetes tipo 2 controlados inadecuadamente con dieta y ejercicio
La Tabla 1 resume las reacciones adversas más comunes (5 5% de los pacientes) notificadas (independientemente de la evaluación de causalidad del investigador) en un período de 24 semanas. Estudio factorial controlado con placebo en el que la sitagliptina y la metformina se administraron conjuntamente a pacientes con diabetes tipo 2 con un control inadecuado de la dieta. y ejercicio.
Tabla 1: Sitagliptina y metformina coadministradas a pacientes con diabetes tipo 2 con control inadecuado de la dieta y el ejercicio: reacciones adversas Informado (independientemente de la evaluación del investigador de la causalidad) en â ‰ ¥ 5% de los pacientes que reciben terapia combinada (y mayor que en los pacientes que reciben Placebo)*
| Número de pacientes (%) | ||||
Placebo |
Sitagliptina 100 mg QD |
Metformina 500 mg / Oferta de 1000 mg de metformina†|
Sitagliptina 50 mg oferta + Metformina 500 mg / Oferta de 1000 mg de metformina†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| Diarrea | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Infección del tracto respiratorio superior | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Dolor de cabeza | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Terapia complementaria con sitagliptina en pacientes con diabetes tipo 2 controlados inadecuadamente con metformina sola
En un ensayo de 24 semanas controlado con placebo de 100 mg de sitagliptina administrados una vez al día añadido a un régimen de metformina dos veces al día, no hubo reacciones adversas informadas independientemente de la evaluación del investigador de la causalidad en â ‰ ¥ 5% de los pacientes y con mayor frecuencia que en los pacientes administrados placebo. La interrupción de la terapia debido a reacciones adversas clínicas fue similar al grupo de tratamiento con placebo (sitagliptina y metformina, 1.9%; placebo y metformina, 2.5%).
Hipoglucemia
Las reacciones adversas de hipoglucemia se basaron en todos los informes de hipoglucemia; no se requirió una medición concurrente de glucosa. La incidencia general de reacciones adversas preespecificadas de hipoglucemia en pacientes con diabetes tipo 2 controlados inadecuadamente con dieta y ejercicio fue de 0.6% en pacientes que recibieron placebo, 0.6% en pacientes que recibieron sitagliptina sola, 0.8% en pacientes que recibieron metformina sola y 1.6% en pacientes que recibieron sitagliptina en combinación con metformina En pacientes con diabetes tipo 2 controlados inadecuadamente con metformina sola, la incidencia general de efectos adversos Las reacciones de hipoglucemia fueron del 1,3% en pacientes que recibieron sitagliptina complementaria y del 2,1% en pacientes que recibieron complemento placebo.
Reacciones adversas gastrointestinales
La incidencia de experiencias adversas gastrointestinales preseleccionadas en pacientes tratados con sitagliptina y metformina fueron similares a las reportadas para pacientes tratados con metformina sola. Ver tabla 2.
Tabla 2: Reacciones adversas gastrointestinales preseleccionadas (independientemente de la evaluación del investigador de la causalidad) informadas en pacientes con diabetes tipo 2 que reciben sitagliptina y metformina.
| Número de pacientes (%) | ||||||
| Estudio de sitagliptina y metformina en pacientes con control inadecuado en dieta y ejercicio |
Estudio del complemento de sitagliptina en pacientes con control inadecuado de metformina sola | |||||
Placebo |
Sitagliptina 100 mg QD |
Metformina 500 mg / Oferta de 1000 mg de metformina* |
Sitagliptina 50 mg oferta + Metformina 500 mg / Oferta de 1000 mg de metformina* |
Placebo y metformina â ‰ ¥ 1500 mg diarios |
Sitagliptina 100 mg QD y metformina â ‰ ¥ 1500 mg diarios |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| Diarrea | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| Náusea | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| Vómitos | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Dolor abdominal†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Sitagliptina en combinación con metformina y glimepirida
En un estudio controlado con placebo de 24 semanas de 100 mg de sitagliptina como terapia complementaria en pacientes con diabetes tipo 2 controlados inadecuadamente con metformina y glimepirida (sitagliptina, N = 116; placebo, N = 113), las reacciones adversas informadas independientemente de la evaluación del investigador de la causalidad en ‰ ¥ 5% de los pacientes tratados con sitagliptina y más comúnmente que en pacientes tratados con placebo fueron: hipoglucemia (sitagliptina, 16.4%; placebo, 0.9%) y dolor de cabeza (6.9%, 2.7%).
No se observaron cambios clínicamente significativos en los signos vitales o en el ECG (incluido el intervalo QTc) con la combinación de sitagliptina y metformina.
La experiencia adversa más común en monoterapia con sitagliptina informada independientemente del investigador La evaluación de la causalidad en â ‰ ¥ 5% de los pacientes y más comúnmente que en los pacientes que recibieron placebo fue nasofaringitis
Las reacciones adversas establecidas más comunes (> 5%) debido al inicio del tratamiento con metformina son diarrea, náuseas / vómitos, flatulencia, molestias abdominales, indigestión, astenia y dolor de cabeza.
Pruebas de laboratorio
Sitagliptina
La incidencia de reacciones adversas de laboratorio fue similar en pacientes tratados con sitagliptina y metformina (7,6%) en comparación con los pacientes tratados con placebo y metformina (8,7%). En la mayoría de los estudios, pero no en todos, un pequeño aumento en el recuento de glóbulos blancos (aproximadamente 200 células / microL de diferencia en WBC versus placebo; Se observó un promedio de glóbulos blancos basales (aproximadamente 6600 células / microL) debido a un pequeño aumento de neutrófilos. Este cambio en los parámetros de laboratorio no se considera clínicamente relevante.
Clorhidrato de metformina
En ensayos clínicos controlados de metformina de 29 semanas de duración, una disminución a niveles subnormales de vitamina B sérica previamente normal12 niveles, sin manifestaciones clínicas, se observó en aproximadamente el 7% de los pacientes. Tal disminución, posiblemente debido a la interferencia con B12 absorción de la B12complejo intrínseco al factor, sin embargo, rara vez se asocia con anemia y parece ser rápidamente reversible con la interrupción de metformina o vitamina B12 suplementación [Ver Advertencias y precauciones.]
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas adicionales durante el uso posterior a la aprobación de Janumet o sitagliptina, uno de los componentes de Janumet. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, generalmente es no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al medicamento.
Las reacciones de hipersensibilidad incluyen anafilaxia, angioedema, erupción cutánea, urticaria, vasculitis cutánea y afecciones cutáneas exfoliativas, incluido el síndrome de Stevens-Johnson [ver Advertencias y precauciones]; infección del tracto respiratorio superior; elevaciones de enzimas hepáticas; pancreatitis
parte superior
Interacciones con la drogas
Drogas catiónicas
Medicamentos catiónicos (por ejemplo, amilorida, digoxina, morfina, procainamida, quinidina, quinina, ranitidina, triamtereno, trimetoprima o vancomicina) que son eliminados por la secreción tubular renal en teoría tienen el potencial de interacción con metformina al competir por el transporte tubular renal común sistemas. Dicha interacción entre metformina y cimetidina oral se ha observado en voluntarios sanos normales en dosis únicas y múltiples de metformina-cimetidina. estudios de interacción farmacológica, con un aumento del 60% en las concentraciones plasmáticas máximas de metformina y sangre total y un aumento del 40% en la metformina plasmática y sanguínea completa AUC No hubo cambios en la vida media de eliminación en el estudio de dosis única. La metformina no tuvo efecto sobre la farmacocinética de cimetidina. Aunque tales interacciones siguen siendo teóricas (a excepción de la cimetidina), el control cuidadoso del paciente y el ajuste de la dosis de Janumet y / o el Se recomienda un fármaco interferente en pacientes que toman medicamentos catiónicos que se excretan a través de la secreción tubular renal proximal. sistema.
Digoxina
Hubo un ligero aumento en el área bajo la curva (AUC, 11%) y la concentración máxima media del fármaco (Cmax, 18%) de digoxina con la administración conjunta de 100 mg de sitagliptina durante 10 días. No se considera que estos aumentos sean clínicamente significativos. La digoxina, como fármaco catiónico, tiene el potencial de competir con la metformina por los sistemas comunes de transporte tubular renal, lo que afecta las concentraciones séricas de digoxina, metformina o ambas. Los pacientes que reciben digoxina deben controlarse adecuadamente. No se recomienda ajustar la dosis de digoxina o Janumet.
Gliburida
En un estudio de interacción de dosis única en pacientes con diabetes tipo 2, la administración conjunta de metformina y gliburida no produjo cambios en la farmacocinética o farmacodinámica de metformina. Disminución de AUC y C de gliburidamax fueron observados, pero fueron muy variables. La naturaleza de dosis única de este estudio y la falta de correlación entre los niveles sanguíneos de gliburida y los efectos farmacodinámicos hacen que la importancia clínica de esta interacción sea incierta.
Furosemida
Un estudio de interacción de medicamentos con dosis única de metformina-furosemida en sujetos sanos demostró que los parámetros farmacocinéticos de ambos compuestos se vieron afectados por la administración conjunta. La furosemida aumentó el plasma de metformina y la sangre Cmax en un 22% y AUC en sangre en un 15%, sin ningún cambio significativo en el aclaramiento renal de metformina. Cuando se administra con metformina, la Cmax y AUC de furosemida fueron 31% y 12% más pequeños, respectivamente, que cuando se administraron solos, y el la vida media terminal disminuyó en un 32%, sin ningún cambio significativo en la furosemida renal despeje. No hay información disponible sobre la interacción de metformina y furosemida cuando se administran de forma crónica.
Nifedipina
Un estudio de interacción de una sola dosis de metformina y nifedipina en voluntarios sanos normales demostró que la administración conjunta de nifedipina aumentó la metformina C en plasmamax y AUC en un 20% y 9%, respectivamente, y aumentaron la cantidad excretada en la orina. Tmax y la vida media no se vieron afectados. La nifedipina parece mejorar la absorción de metformina. La metformina tuvo efectos mínimos sobre la nifedipina.
El uso de metformina con otras drogas
Ciertos medicamentos tienden a producir hiperglucemia y pueden conducir a la pérdida del control glucémico. Estos medicamentos incluyen las tiazidas y otros diuréticos, corticosteroides, fenotiazinas, productos tiroideos, estrógenos, anticonceptivos orales, fenitoína, ácido nicotínico, simpaticomiméticos, fármacos bloqueantes de los canales de calcio y isoniazida Cuando tales medicamentos se administran a un paciente que recibe Janumet, se debe observar de cerca al paciente para mantener un control glucémico adecuado.
En voluntarios sanos, la farmacocinética de metformina y propranolol, y metformina e ibuprofeno no se vieron afectados cuando se administraron conjuntamente en estudios de interacción de dosis única.
La metformina se une de manera insignificante a las proteínas plasmáticas y, por lo tanto, es menos probable que interactúe con medicamentos altamente unidos a proteínas, como salicilatos, sulfonamidas, cloranfenicol y probenecid, en comparación con las sulfonilureas, que se unen ampliamente al suero proteínas
parte superior
Uso en poblaciones específicas
El embarazo
Embarazo Categoría B:
Janumet
No existen estudios adecuados y bien controlados en mujeres embarazadas con Janumet o sus componentes individuales; por lo tanto, no se conoce la seguridad de Janumet en mujeres embarazadas. Janumet debe usarse durante el embarazo solo si es claramente necesario.
Merck & Co., Inc. mantiene un registro para monitorear los resultados del embarazo de las mujeres expuestas a Janumet durante el embarazo. Se alienta a los proveedores de atención médica a informar cualquier exposición prenatal a Janumet llamando al Registro de embarazo al (800) 986-8999.
No se han realizado estudios en animales con los productos combinados en Janumet para evaluar los efectos sobre la reproducción. Los siguientes datos se basan en hallazgos en estudios realizados con sitagliptina o metformina individualmente.
Sitagliptina
Se han realizado estudios de reproducción en ratas y conejos. Las dosis de sitagliptina de hasta 125 mg / kg (aproximadamente 12 veces la exposición humana a la dosis humana máxima recomendada) no afectaron la fertilidad ni dañaron al feto. Sin embargo, no existen estudios adecuados y bien controlados con sitagliptina en mujeres embarazadas.
La sitagliptina administrada a ratas y conejas preñadas desde el día 6 al 20 de gestación (organogénesis) no fue teratogénica a dosis orales de hasta 250 mg / kg. (ratas) y 125 mg / kg (conejos), o aproximadamente 30 y 20 veces la exposición humana a la dosis humana máxima recomendada (MRHD) de 100 mg / día según el AUC comparaciones Dosis más altas aumentaron la incidencia de malformaciones de costillas en la descendencia a 1000 mg / kg, o aproximadamente 100 veces la exposición humana en el MRHD.
La sitagliptina administrada a ratas hembras desde el día 6 de gestación hasta el día 21 de lactancia disminuyó el peso corporal en la descendencia masculina y femenina a 1000 mg / kg. No se observó toxicidad funcional o conductual en las crías de ratas.
La transferencia placentaria de sitagliptina administrada a ratas preñadas fue aproximadamente del 45% a las 2 horas y del 80% a las 24 horas después de la dosis. La transferencia placentaria de sitagliptina administrada a conejos preñadas fue aproximadamente del 66% a las 2 horas y del 30% a las 24 horas.
Clorhidrato de metformina
La metformina no fue teratogénica en ratas y conejos a dosis de hasta 600 mg / kg / día. Esto representa una exposición de aproximadamente 2 y 6 veces la dosis diaria máxima recomendada en humanos de 2,000 mg según las comparaciones del área de superficie corporal para ratas y conejos, respectivamente. La determinación de las concentraciones fetales demostró una barrera placentaria parcial a la metformina.
Madres lactantes
No se han realizado estudios en animales lactantes con los componentes combinados de Janumet. En estudios realizados con los componentes individuales, tanto la sitagliptina como la metformina se secretan en la leche de las ratas lactantes. No se sabe si sitagliptina se excreta en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana, se debe tener precaución cuando Janumet se administra a una mujer lactante.
Uso pediátrico
No se ha establecido la seguridad y eficacia de Janumet en pacientes pediátricos menores de 18 años.
Uso geriátrico
Janumet
Debido a que la sitagliptina y la metformina se excretan sustancialmente por el riñón y al envejecimiento puede asociarse con una función renal reducida, Janumet debe usarse con precaución a medida que aumenta la edad. Se debe tener cuidado en la selección de dosis y se debe basar en un control cuidadoso y regular de la función renal. [Ver Advertencias y precauciones; Farmacología Clínica.]
Sitagliptina
Del número total de sujetos (N = 3884) en los estudios clínicos de fase II y III de sitagliptina, 725 pacientes tenían 65 años o más, mientras que 61 pacientes tenían 75 años o más. No se observaron diferencias generales en seguridad o efectividad entre los sujetos de 65 años o más y los sujetos más jóvenes. Si bien esta y otras experiencias clínicas informadas no han identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes, no se puede lograr una mayor sensibilidad de algunas personas mayores descartado.
Clorhidrato de metformina
Los estudios clínicos controlados de metformina no incluyeron un número suficiente de pacientes de edad avanzada para determinar si responden de manera diferente de pacientes más jóvenes, aunque otra experiencia clínica informada no ha identificado diferencias en las respuestas entre ancianos y jóvenes pacientes La metformina solo debe usarse en pacientes con función renal normal. La dosificación inicial y de mantenimiento de metformina debe ser conservadora en pacientes con edad avanzada, debido al potencial de disminución de la función renal en esta población. Cualquier ajuste de dosis debe basarse en una evaluación cuidadosa de la función renal. [Ver Contraindicaciones; Advertencias y precauciones; y Farmacología Clínica.]
parte superior
Sobredosis
Sitagliptina
Durante los ensayos clínicos controlados en sujetos sanos, se administraron dosis únicas de hasta 800 mg de sitagliptina. Se observaron aumentos medios máximos en QTc de 8.0 ms en un estudio a una dosis de 800 mg de sitagliptina, un efecto medio que no se considera clínicamente importante [ver Farmacología Clínica]. No hay experiencia con dosis superiores a 800 mg en humanos. En los estudios de dosis múltiples de Fase I, no se observaron reacciones clínicas adversas relacionadas con la dosis con sitagliptina con dosis de hasta 400 mg por día durante períodos de hasta 28 días.
En caso de sobredosis, es razonable emplear las medidas de apoyo habituales, por ejemplo, eliminar el material no absorbido del tubo digestivo. del tracto, emplee monitorización clínica (incluida la obtención de un electrocardiograma) e instituya una terapia de apoyo según lo indique la clínica del paciente estado.
La sitagliptina es moderadamente dializable. En estudios clínicos, aproximadamente el 13.5% de la dosis se eliminó durante una sesión de hemodiálisis de 3 a 4 horas. La hemodiálisis prolongada puede considerarse si es clínicamente apropiada. No se sabe si la sitagliptina es dializable por diálisis peritoneal.
Clorhidrato de metformina
Se ha producido una sobredosis de clorhidrato de metformina, incluida la ingestión de cantidades superiores a 50 gramos. Se informó hipoglucemia en aproximadamente el 10% de los casos, pero no se ha establecido una asociación causal con el clorhidrato de metformina. Se ha informado acidosis láctica en aproximadamente el 32% de los casos de sobredosis de metformina [ver Advertencias y precauciones]. La metformina es dializable con un aclaramiento de hasta 170 ml / min en buenas condiciones hemodinámicas. Por lo tanto, la hemodiálisis puede ser útil para eliminar el fármaco acumulado de pacientes en quienes se sospecha una sobredosis de metformina.
parte superior
Descripción
Los comprimidos de Janumet (sitagliptina / metformina HCl) contienen dos fármacos antihiperglucémicos orales utilizados en el tratamiento de la diabetes tipo 2: sitagliptina y clorhidrato de metformina.
Sitagliptina
La sitagliptina es un inhibidor activo por vía oral de la enzima dipeptidil peptidasa-4 (DPP-4). La sitagliptina está presente en tabletas Janumet en forma de monohidrato de fosfato de sitagliptina. El monohidrato de fosfato de sitagliptina se describe químicamente como 7 - [(3R) - 3 - amino - 1 - oxo - 4 - (2,4,5 - trifluorofenil) butilo] - 5,6,7,8 - tetrahidro - 3 - (trifluorometil) - 1,2,4 - triazolo [4,3 - a] fosfato de pirazina (1: 1) monohidrato con una fórmula empírica De c16H15F6norte5OH3correos4-H2O y un peso molecular de 523.32. La fórmula estructural es:
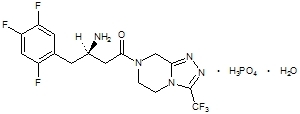
El monohidrato de fosfato de sitagliptina es un polvo blanco a blanquecino, cristalino, no higroscópico. Es soluble en agua y N, N-dimetilformamida; ligeramente soluble en metanol; muy poco soluble en etanol, acetona y acetonitrilo; e insoluble en isopropanol y acetato de isopropilo.
Clorhidrato de metformina
El clorhidrato de metformina (clorhidrato de diamida N, N-dimetilimidodicarbonimídico) no está relacionado química ni farmacológicamente con ninguna otra clase de agentes antihiperglucémicos orales. El clorhidrato de metformina es un compuesto cristalino blanco a blanquecino con una fórmula molecular de C4H11norte5-HCl y un peso molecular de 165.63. El clorhidrato de metformina es libremente soluble en agua y es prácticamente insoluble en acetona, éter y cloroformo. El pKun de metformina es 12.4. El pH de una solución acuosa al 1% de clorhidrato de metformina es 6.68. La fórmula estructural es como se muestra:
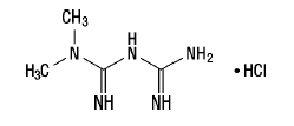
Janumet
Janumet está disponible para administración oral en tabletas que contienen 64,25 mg de monohidrato de fosfato de sitagliptina y equivalente de hidrocloruro de metformina a: 50 mg de sitagliptina como base libre y 500 mg de clorhidrato de metformina (Janumet 50 mg / 500 mg) o 1000 mg de clorhidrato de metformina (Janumet 50 mg / 1000 mg). Cada comprimido recubierto con película de Janumet contiene los siguientes ingredientes inactivos: celulosa microcristalina, polivinilpirrolidona, laurilsulfato de sodio y estearilfumarato de sodio. Además, el recubrimiento de película contiene los siguientes ingredientes inactivos: alcohol polivinílico, polietilenglicol, talco, dióxido de titanio, óxido de hierro rojo y óxido de hierro negro.
parte superior
Farmacología Clínica
Mecanismo de acción
Janumet
Janumet combina dos agentes antihiperglucémicos con mecanismos de acción complementarios para mejorar el control glucémico en pacientes con diabetes tipo 2: sitagliptina, un inhibidor de la dipeptidil peptidasa-4 (DPP-4) e hidrocloruro de metformina, un miembro de la biguanida clase.
Sitagliptina
La sitagliptina es un inhibidor de la DPP-4, que se cree que ejerce sus acciones en pacientes con diabetes tipo 2 al disminuir la inactivación de las hormonas incretinas. La sitagliptina aumenta las concentraciones de las hormonas intactas activas, lo que aumenta y prolonga la acción de estas hormonas. Hormonas incretinas, incluido el péptido 1 similar al glucagón (GLP-1) y el insulinotrópico dependiente de glucosa polipéptido (GIP), son liberados por el intestino durante todo el día, y los niveles aumentan en respuesta a una comida Estas hormonas son rápidamente inactivadas por la enzima DPP-4. Las incretinas son parte de un sistema endógeno implicado en la regulación fisiológica de la homeostasis de la glucosa. Cuando las concentraciones de glucosa en sangre son normales o elevadas, GLP-1 y GIP aumentan la síntesis de insulina y la liberación de las células beta pancreáticas por vías de señalización intracelular que involucran AMP cíclico. GLP-1 también reduce la secreción de glucagón de las células alfa pancreáticas, lo que reduce la producción de glucosa hepática. Al aumentar y prolongar los niveles de incretina activa, la sitagliptina aumenta la liberación de insulina y disminuye los niveles de glucagón en la circulación de manera dependiente de la glucosa. La sitagliptina demuestra selectividad para DPP-4 y no inhibe la actividad de DPP-8 o DPP-9 in vitro a concentraciones que se aproximan a las de las dosis terapéuticas.
Clorhidrato de metformina
La metformina es un agente antihiperglucémico que mejora la tolerancia a la glucosa en pacientes con diabetes tipo 2, reduciendo la glucosa plasmática tanto basal como posprandial. Sus mecanismos de acción farmacológicos son diferentes de otras clases de agentes antihiperglucémicos orales. La metformina disminuye la producción de glucosa hepática, disminuye la absorción intestinal de glucosa y mejora la sensibilidad a la insulina al aumentar la absorción y utilización de glucosa periférica. A diferencia de las sulfonilureas, la metformina no produce hipoglucemia ni en pacientes con diabetes tipo 2 ni en sujetos normales (excepto en circunstancias especiales [ver Advertencias y precauciones]) y no causa hiperinsulinemia. Con la terapia con metformina, la secreción de insulina permanece sin cambios mientras que los niveles de insulina en ayunas y la respuesta de insulina en plasma durante todo el día pueden disminuir.
12.2 Farmacodinámica
Sitagliptina
General
En pacientes con diabetes tipo 2, la administración de sitagliptina condujo a la inhibición de la actividad de la enzima DPP-4 durante un período de 24 horas. Después de una carga de glucosa oral o una comida, esta inhibición de DPP-4 resultó en un aumento de 2 a 3 veces en los niveles circulantes de GLP-1 activo y GIP, Disminución de las concentraciones de glucagón y aumento de la capacidad de respuesta de la liberación de insulina a la glucosa, lo que resulta en un mayor péptido C e insulina. concentraciones El aumento de la insulina con la disminución del glucagón se asoció con concentraciones más bajas de glucosa en ayunas y una reducción de la excursión de glucosa después de una carga de glucosa oral o una comida.
Administración conjunta de sitagliptina y clorhidrato de metformina
En un estudio de dos días en sujetos sanos, la sitagliptina sola aumentó las concentraciones activas de GLP-1, mientras que la metformina sola aumentó las concentraciones activas y totales de GLP-1 en cantidades similares. La administración conjunta de sitagliptina y metformina tuvo un efecto aditivo sobre las concentraciones activas de GLP-1. La sitagliptina, pero no la metformina, aumentó las concentraciones activas de GIP. No está claro qué significan estos hallazgos para los cambios en el control glucémico en pacientes con diabetes tipo 2.
En estudios con sujetos sanos, la sitagliptina no disminuyó la glucosa en sangre ni causó hipoglucemia.
Electrofisiología cardíaca
En un estudio cruzado aleatorizado, controlado con placebo, 79 sujetos sanos recibieron una dosis oral única de sitagliptina 100 mg, sitagliptina 800 mg (8 veces la dosis recomendada) y placebo. A la dosis recomendada de 100 mg, no hubo ningún efecto sobre el intervalo QTc obtenido en la concentración plasmática máxima, o en cualquier otro momento durante el estudio. Después de la dosis de 800 mg, el aumento máximo en el cambio medio corregido por placebo en QTc desde el inicio a las 3 horas después de la dosis fue de 8.0 ms. Este aumento no se considera clínicamente significativo. A la dosis de 800 mg, las concentraciones plasmáticas máximas de sitagliptina fueron aproximadamente 11 veces más altas que las concentraciones máximas después de una dosis de 100 mg.
En pacientes con diabetes tipo 2 a los que se les administró sitagliptina 100 mg (N = 81) o sitagliptina 200 mg (N = 63) al día, hay no hubo cambios significativos en el intervalo QTc según los datos de ECG obtenidos en el momento del pico de plasma esperado concentración.
Farmacocinética
Janumet
Los resultados de un estudio de bioequivalencia en sujetos sanos demostraron que Janumet (sitagliptina / metformina HCl) 50 mg / 500 Los comprimidos combinados de mg y 50 mg / 1000 mg son bioequivalentes a la administración conjunta de las dosis correspondientes de sitagliptina (JANUVIA™2) y metformina hidrocloruro como comprimidos individuales.
Absorción
Sitagliptina
La biodisponibilidad absoluta de sitagliptina es aproximadamente del 87%. La administración conjunta de una comida rica en grasas con sitagliptina no tuvo efecto sobre la farmacocinética de sitagliptina.
Clorhidrato de metformina
La biodisponibilidad absoluta de una tableta de 500 mg de hidrocloruro de metformina administrada en ayunas es de aproximadamente 50-60%. Los estudios que usan dosis orales únicas de tabletas de hidrocloruro de metformina de 500 mg a 1500 mg y de 850 mg a 2550 mg indican que existe una falta de proporcionalidad de la dosis con dosis crecientes, que se debe a una disminución de la absorción en lugar de una alteración en la eliminación. Los alimentos disminuyen la extensión y retrasan ligeramente la absorción de metformina, como lo demuestra una concentración plasmática máxima media aproximadamente 40% menor (Cmax), un área 25% menor bajo la curva de concentración plasmática versus tiempo (AUC) y una prolongación del tiempo de 35 minutos hasta la concentración plasmática máxima (Tmax) después de la administración de una sola tableta de metformina de 850 mg con alimentos, en comparación con la misma dosis de tableta administrada en ayunas. Se desconoce la relevancia clínica de estas disminuciones.
Distribución
Sitagliptina
El volumen medio de distribución en estado estacionario después de una dosis intravenosa única de 100 mg de sitagliptina a sujetos sanos es de aproximadamente 198 litros. La fracción de sitagliptina unida reversiblemente a las proteínas plasmáticas es baja (38%).
Clorhidrato de metformina
El volumen aparente de distribución (V / F) de metformina después de dosis orales únicas de tabletas de hidrocloruro de metformina 850 mg promedió 654 ± 358 L. La metformina se une de manera insignificante a las proteínas plasmáticas, en contraste con las sulfonilureas, que están unidas a proteínas en más del 90%. La metformina se divide en eritrocitos, muy probablemente en función del tiempo. A las dosis clínicas habituales y los horarios de dosificación de las tabletas de hidrocloruro de metformina, las concentraciones plasmáticas de metformina en el estado estacionario se alcanzan dentro de las 24-48 horas y generalmente son
Metabolismo
Sitagliptina
Aproximadamente el 79% de la sitagliptina se excreta sin cambios en la orina y el metabolismo es una vía menor de eliminación.
Siguiendo un [14C] dosis oral de sitagliptina, aproximadamente el 16% de la radiactividad se excreta como metabolitos de sitagliptina. Se detectaron seis metabolitos a niveles traza y no se espera que contribuyan a la actividad inhibidora de DPP-4 en plasma de sitagliptina. Los estudios in vitro indicaron que la enzima principal responsable del metabolismo limitado de sitagliptina fue CYP3A4, con contribución de CYP2C8.
Clorhidrato de metformina
Los estudios de dosis única intravenosa en sujetos normales demuestran que la metformina se excreta sin cambios en el orina y no sufre metabolismo hepático (no se han identificado metabolitos en humanos) ni biliar excreción.
Excreción
Sitagliptina
Tras la administración de un [14C] dosis de sitagliptina a sujetos sanos, aproximadamente el 100% de la radiactividad administrada se eliminó en las heces (13%) o la orina (87%) dentro de una semana de la dosificación. La aparente terminal t1/2 después de una dosis oral de 100 mg de sitagliptina fue de aproximadamente 12,4 horas y el aclaramiento renal fue de aproximadamente 350 ml / min.
La eliminación de sitagliptina ocurre principalmente a través de la excreción renal e implica la secreción tubular activa. La sitagliptina es un sustrato para el transportador de aniones orgánicos humanos 3 (hOAT-3), que puede estar involucrado en la eliminación renal de sitagliptina. No se ha establecido la relevancia clínica de hOAT-3 en el transporte de sitagliptina. La sitagliptina también es un sustrato de la glicoproteína p, que también puede estar involucrada en la eliminación renal de la sitagliptina. Sin embargo, la ciclosporina, un inhibidor de la glicoproteína p, no redujo el aclaramiento renal de sitagliptina.
Clorhidrato de metformina
El aclaramiento renal es aproximadamente 3.5 veces mayor que el aclaramiento de creatinina, lo que indica que la secreción tubular es la ruta principal de eliminación de metformina. Después de la administración oral, aproximadamente el 90% del fármaco absorbido se elimina por vía renal dentro de las primeras 24 horas, con una vida media de eliminación plasmática de aproximadamente 6,2 horas. En sangre, la vida media de eliminación es de aproximadamente 17,6 horas, lo que sugiere que la masa de eritrocitos puede ser un compartimento de distribución.
Poblaciones Especiales
Insuficiencia renal
Janumet
Janumet no debe usarse en pacientes con insuficiencia renal [ver Contraindicaciones; Advertencias y precauciones].
Sitagliptina
Se observó un aumento de aproximadamente 2 veces en el AUC plasmático de sitagliptina en pacientes con insuficiencia renal moderada, y aproximadamente 4 veces Se observó un aumento en pacientes con insuficiencia renal grave, incluidos pacientes con ESRD en hemodiálisis, en comparación con el control saludable normal asignaturas.
Clorhidrato de metformina
En pacientes con función renal disminuida (según el aclaramiento de creatinina medido), la vida media plasmática y sanguínea de metformina se prolonga y el aclaramiento renal disminuye en proporción a la disminución de creatinina despeje.
Insuficiencia Hepática
Sitagliptina
En pacientes con insuficiencia hepática moderada (puntuación de Child-Pugh de 7 a 9), AUC media y Cmax de sitagliptina aumentó aproximadamente 21% y 13%, respectivamente, en comparación con controles sanos pareados después de la administración de una dosis única de 100 mg de sitagliptina. Estas diferencias no se consideran clínicamente significativas.
No hay experiencia clínica en pacientes con insuficiencia hepática grave (puntuación de Child-Pugh> 9).
Clorhidrato de metformina
No se han realizado estudios farmacocinéticos de metformina en pacientes con insuficiencia hepática.
Género
Sitagliptina
El género no tuvo un efecto clínicamente significativo sobre la farmacocinética de sitagliptina basada en un compuesto análisis de datos farmacocinéticos de fase I y en un análisis farmacocinético poblacional de fase I y fase II datos.
Clorhidrato de metformina
Los parámetros farmacocinéticos de metformina no difirieron significativamente entre los sujetos normales y los pacientes con diabetes tipo 2 cuando se analizaron según el género. Del mismo modo, en estudios clínicos controlados en pacientes con diabetes tipo 2, el efecto antihiperglucémico de metformina fue comparable en hombres y mujeres.
Geriátrico
Sitagliptina
Cuando se tienen en cuenta los efectos de la edad sobre la función renal, la edad sola no tenía clínicamente Impacto significativo en la farmacocinética de sitagliptina basada en una población farmacocinética. análisis. Los sujetos de edad avanzada (65 a 80 años) tenían concentraciones plasmáticas de sitagliptina aproximadamente un 19% más altas en comparación con los sujetos más jóvenes.
Clorhidrato de metformina
Los datos limitados de estudios farmacocinéticos controlados de metformina en sujetos ancianos sanos sugieren que el aclaramiento plasmático total de metformina disminuye, la vida media se prolonga y Cmax se incrementa, en comparación con sujetos jóvenes sanos. A partir de estos datos, parece que el cambio en la farmacocinética de metformina con el envejecimiento se explica principalmente por un cambio en la función renal (ver GLUCOPHAGE3 información de prescripción: FARMACOLOGÍA CLÍNICA, Poblaciones especiales, Geriatría).
El tratamiento con Janumet no debe iniciarse en pacientes de 80 años de edad a menos que la medición del aclaramiento de creatinina demuestre que la función renal no se reduce [ver Advertencias y precauciones].
Pediátrico
No se han realizado estudios con Janumet en pacientes pediátricos.
Carrera
Sitagliptina
La raza no tuvo un efecto clínicamente significativo sobre la farmacocinética de sitagliptina según un análisis compuesto de datos farmacocinéticos disponibles, incluidos sujetos de raza blanca, hispana, negra, asiática y otras razas grupos
Clorhidrato de metformina
No se han realizado estudios de parámetros farmacocinéticos de metformina según la raza. En estudios clínicos controlados de metformina en pacientes con diabetes tipo 2, el efecto antihiperglucémico fue comparable en blancos (n = 249), negros (n = 51) e hispanos (n = 24).
Índice de masa corporal (IMC)
Sitagliptina
El índice de masa corporal no tuvo un efecto clínicamente significativo sobre la farmacocinética de sitagliptina basada en un compuesto análisis de datos farmacocinéticos de fase I y en un análisis farmacocinético poblacional de fase I y fase II datos.
Interacciones con la drogas
Sitagliptina y clorhidrato de metformina
La administración conjunta de dosis múltiples de sitagliptina (50 mg) y metformina (1000 mg) administradas dos veces al día no alterar significativamente la farmacocinética de sitagliptina o metformina en pacientes con tipo 2 diabetes.
No se han realizado estudios de interacción farmacocinética de medicamentos con Janumet; sin embargo, dichos estudios se han realizado con los componentes individuales de Janumet (sitagliptina y clorhidrato de metformina).
Sitagliptina
Evaluación in vitro de interacciones farmacológicas
La sitagliptina no es un inhibidor de las isoenzimas CYP CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 o 2B6, y no es un inductor de CYP3A4. La sitagliptina es un sustrato de la glicoproteína p, pero no inhibe el transporte de digoxina mediado por la glicoproteína p. En base a estos resultados, se considera improbable que la sitagliptina cause interacciones con otras drogas que utilizan estas vías.
La sitagliptina no se une ampliamente a las proteínas plasmáticas. Por lo tanto, la propensión de la sitagliptina a participar en interacciones farmacológicas clínicamente significativas mediadas por el desplazamiento de unión a proteínas plasmáticas es muy baja.
Evaluación in vivo de interacciones farmacológicas
Efecto de la sitagliptina sobre otras drogas
En estudios clínicos, como se describe a continuación, la sitagliptina no alteró significativamente la farmacocinética de metformina, gliburida, simvastatina, rosiglitazona, warfarina u oral. anticonceptivos, que proporcionan evidencia in vivo de una baja propensión a causar interacciones farmacológicas con sustratos de CYP3A4, CYP2C8, CYP2C9 y transportador catiónico orgánico (OCT).
Digoxina: la sitagliptina tuvo un efecto mínimo sobre la farmacocinética de la digoxina. Tras la administración de 0,25 mg de digoxina concomitantemente con 100 mg de sitagliptina al día durante 10 días, el AUC plasmático de digoxina se incrementó en un 11% y el plasma Cmax en un 18%.
Sulfonilureas: la farmacocinética de dosis única de gliburida, un sustrato de CYP2C9, no se alteró significativamente en sujetos que recibieron dosis múltiples de sitagliptina. No se esperarían interacciones clínicamente significativas con otras sulfonilureas (por ejemplo, glipizida, tolbutamida y glimepirida) que, como la gliburida, son eliminadas principalmente por CYP2C9 [ver Advertencias y precauciones].
Simvastatina: la farmacocinética de dosis única de simvastatina, un sustrato de CYP3A4, no se alteró significativamente en los sujetos que recibieron múltiples dosis diarias de sitagliptina. Por lo tanto, la sitagliptina no es un inhibidor del metabolismo mediado por CYP3A4.
Tiazolidinedionas: la farmacocinética de dosis única de rosiglitazona no se alteró significativamente en los sujetos recibir múltiples dosis diarias de sitagliptina, lo que indica que la sitagliptina no es un inhibidor de CYP2C8 mediado metabolismo.
Warfarina: múltiples dosis diarias de sitagliptina no alteraron significativamente la farmacocinética, según lo evaluado mediante la medición de Enantiómeros de warfarina S (-) o R (+), o farmacodinámica (según lo evaluado mediante la medición de protrombina INR) de una dosis única de warfarina Debido a que la warfarina S (-) es metabolizada principalmente por CYP2C9, estos datos también respaldan la conclusión de que la sitagliptina no es un inhibidor de CYP2C9.
Anticonceptivos orales: la administración conjunta con sitagliptina no alteró significativamente la farmacocinética en estado estacionario de noretindrona o etinilestradiol.
Efecto de otros medicamentos sobre la sitagliptina
Los datos clínicos descritos a continuación sugieren que la sitagliptina no es susceptible a interacciones clínicamente significativas por medicamentos administrados conjuntamente.
Ciclosporina: se realizó un estudio para evaluar el efecto de la ciclosporina, un potente inhibidor de la glicoproteína p, sobre la farmacocinética de la sitagliptina. La administración conjunta de una dosis oral única de 100 mg de sitagliptina y una dosis oral única de 600 mg de ciclosporina aumentó el AUC y Cmax de sitagliptina en aproximadamente 29% y 68%, respectivamente. Estos modestos cambios en la farmacocinética de sitagliptina no se consideraron clínicamente significativos. El aclaramiento renal de sitagliptina tampoco se alteró significativamente. Por lo tanto, no se esperarían interacciones significativas con otros inhibidores de la glicoproteína p.
Clorhidrato de metformina
[Ver Interacciones con la drogas]
parte superior
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Janumet
No se han realizado estudios en animales con los productos combinados en Janumet para evaluar la carcinogénesis, mutagénesis o deterioro de la fertilidad. Los siguientes datos se basan en los hallazgos en estudios con sitagliptina y metformina individualmente.
Sitagliptina
Se realizó un estudio de carcinogenicidad de dos años en ratas machos y hembras que recibieron dosis orales de sitagliptina de 50, 150 y 500 mg / kg / día. Hubo una mayor incidencia de adenoma / carcinoma hepático combinado en hombres y mujeres y de carcinoma hepático en mujeres a 500 mg / kg. Esta dosis da como resultado exposiciones aproximadamente 60 veces la exposición humana a la dosis humana diaria máxima recomendada para adultos (MRHD) de 100 mg / día según las comparaciones de AUC. No se observaron tumores hepáticos a 150 mg / kg, aproximadamente 20 veces la exposición humana en el MRHD. Se realizó un estudio de carcinogenicidad de dos años en ratones machos y hembras que recibieron dosis orales de sitagliptina de 50, 125, 250 y 500 mg / kg / día. No hubo aumento en la incidencia de tumores en ningún órgano hasta 500 mg / kg, aproximadamente 70 veces la exposición humana en el MRHD. La sitagliptina no fue mutagénica o clastogénica con o sin activación metabólica en el ensayo de mutagenicidad bacteriana de Ames, un ovario de hámster chino (CHO) un ensayo de aberración cromosómica, un ensayo de citogenética in vitro en CHO, un ensayo de elución alcalina de ADN de hepatocitos de rata in vitro y un micronúcleo in vivo ensayo.
En estudios de fertilidad en ratas con dosis de sonda oral de 125, 250 y 1000 mg / kg, los machos fueron tratados durante 4 semanas antes del apareamiento, durante apareamiento, hasta la terminación programada (aproximadamente 8 semanas en total), y las hembras fueron tratadas 2 semanas antes del apareamiento hasta la gestación día 7 No se observaron efectos adversos sobre la fertilidad a 125 mg / kg (aproximadamente 12 veces la exposición humana a la MRHD de 100 mg / día según las comparaciones de AUC). A dosis más altas, se observaron resorciones aumentadas no relacionadas con la dosis en las mujeres (aproximadamente 25 y 100 veces la exposición humana en el MRHD según la comparación de AUC).
Clorhidrato de metformina
Se han realizado estudios de carcinogenicidad a largo plazo en ratas (duración de la dosis de 104 semanas) y ratones. (duración de la dosis de 91 semanas) a dosis de hasta 900 mg / kg / día e inclusive 1500 mg / kg / día, respectivamente. Estas dosis son aproximadamente cuatro veces la dosis diaria máxima recomendada en humanos de 2000 mg según las comparaciones del área de superficie corporal. No se encontró evidencia de carcinogenicidad con metformina en ratones machos o hembras. Del mismo modo, no se observó potencial tumorigénico con metformina en ratas macho. Sin embargo, hubo una mayor incidencia de pólipos uterinos estromales benignos en ratas hembras tratadas con 900 mg / kg / día.
No hubo evidencia de un potencial mutagénico de metformina en las siguientes pruebas in vitro: prueba de Ames (S. typhimurium), prueba de mutación genética (células de linfoma de ratón) o prueba de aberraciones cromosómicas (linfocitos humanos). Los resultados en la prueba de micronúcleos de ratón in vivo también fueron negativos. La fertilidad de las ratas macho o hembra no se vio afectada por la metformina cuando se administra a dosis tan altas como 600 mg / kg / día, que es aproximadamente tres veces la dosis diaria máxima recomendada en humanos según el área de superficie corporal comparaciones
parte superior
Estudios clínicos
La administración conjunta de sitagliptina y metformina se ha estudiado en pacientes con diabetes tipo 2 con control inadecuado de la dieta y el ejercicio y en combinación con glimepirida.
No se han realizado estudios de eficacia clínica con Janumet; sin embargo, se demostró la bioequivalencia de Janumet con comprimidos de clorhidrato de metformina y sitagliptina administrados conjuntamente.
Administración conjunta de sitagliptina y metformina en pacientes con diabetes tipo 2 controlados inadecuadamente con dieta y ejercicio
Un total de 1091 pacientes con diabetes tipo 2 y control glucémico inadecuado de la dieta y el ejercicio participaron en un estudio de 24 semanas, estudio factorial aleatorizado, doble ciego, controlado con placebo diseñado para evaluar la eficacia de sitagliptina y metformina coadministración Los pacientes con un agente antihiperglucémico (N = 541) se sometieron a una dieta, ejercicio y período de lavado de drogas de hasta 12 semanas de duración. Después del período de lavado, los pacientes con control glucémico inadecuado (A1C 7.5% a 11%) fueron asignados al azar después de completar un período de preinclusión placebo-placebo de 2 semanas. Pacientes que no toman agentes antihiperglucémicos al ingreso al estudio (N = 550) con control glucémico inadecuado (A1C 7,5% a 11%) ingresaron de inmediato al período de preinclusión con placebo ciego simple de 2 semanas y luego fueron aleatorizado Se aleatorizaron números aproximadamente iguales de pacientes para recibir placebo, 100 mg de sitagliptina una vez al día, 500 mg o 1000 mg de metformina dos veces al día, o 50 mg de sitagliptina dos veces al día en combinación con 500 mg o 1000 mg de metformina dos veces diario. Los pacientes que no lograron cumplir objetivos glucémicos específicos durante el estudio fueron tratados con rescate de glibenclamida (glibenclamida).
La administración conjunta de sitagliptina y metformina proporcionó mejoras significativas en A1C, FPG y PPG de 2 horas en comparación con placebo, metformina sola y sitagliptina sola (Tabla 3, Figura 1). Las reducciones medias del valor basal en A1C fueron generalmente mayores para los pacientes con valores más altos de A1C basal. Para los pacientes que no recibieron un agente antihiperglucémico al inicio del estudio, las reducciones medias desde el inicio en A1C fueron: sitagliptina 100 mg una vez al día, -1.1%; metformina 500 mg oferta, -1.1%; metformina 1000 mg oferta, -1,2%; sitagliptina 50 mg dos veces con metformina 500 mg dos veces, -1.6%; sitagliptina 50 mg bid con metformina 1000 mg bid, -1.9%; y para pacientes que reciben placebo, -0.2%. Los efectos de los lípidos fueron generalmente neutros. La disminución en el peso corporal en los grupos que recibieron sitagliptina en combinación con metformina fue similar a la de los grupos que recibieron metformina sola o placebo.
Tabla 3: Parámetros glucémicos en la visita final (estudio de 24 semanas) para sitagliptina y metformina, solos y en combinación en pacientes con diabetes tipo 2 controlados inadecuadamente con dieta y ejercicio *
Placebo |
Sitagliptina 100 mg QD |
Metformina Oferta de 500 mg |
Metformina Oferta de 1000 mg |
Sitagliptina 50 mg oferta + Metformina Oferta de 500 mg |
Sitagliptina 50 mg oferta + Metformina Oferta de 1000 mg |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Línea de base (media) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Cambio desde el inicio (media ajustada†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Diferencia con placebo (media ajustada†) (IC 95%) |
-0.8C (-1.1, -0.6) |
-1.0C (-1.2, -0.8) |
-1.3C (-1.5, -1.1) |
-1.6C (-1.8, -1.3) |
-2.1C (-2.3, -1.8) |
|
| Pacientes (%) que logran A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % De pacientes que reciben medicación de rescate | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dL) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Línea de base (media) | 196 | 201 | 205 | 197 | 204 | 197 |
| Cambio desde el inicio (media ajustada†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Diferencia con placebo (media ajustada†) (IC 95%) |
-23C (-33, -14) |
-33C (-43, -24) |
-35C (-45, -26) |
-53C (-62, -43) |
-70C (-79, -60) |
|
| PPG de 2 horas (mg / dL) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Línea de base (media) | 277 | 285 | 293 | 283 | 292 | 287 |
| Cambio desde el inicio (media ajustada†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Diferencia con placebo (media ajustada†) (IC 95%) |
-52C (-67, -37) |
-54C (-69, -39) |
-78C (-93, -63) |
-93C (-107, -78) |
-117C (-131, -102) |
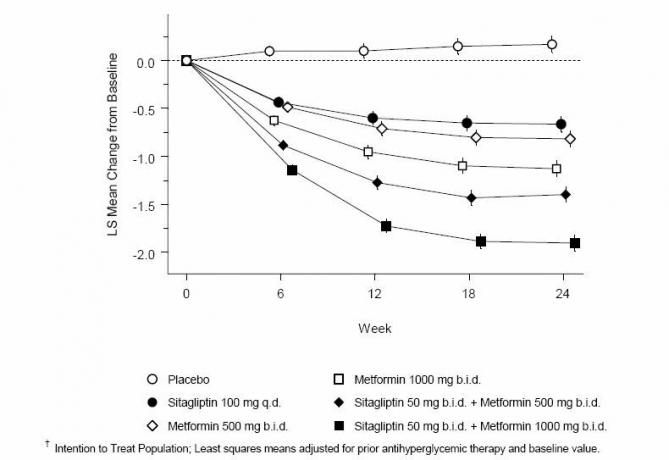
Figura 1: Cambio medio con respecto al valor inicial para A1C (%) durante 24 semanas con sitagliptina y metformina, solo y en combinación en pacientes con diabetes tipo 2 controlados inadecuadamente con dieta y ejercicio ”
Además, este estudio incluyó pacientes (N = 117) con hiperglucemia más grave (A1C> 11% o sangre glucosa> 280 mg / dL) que fueron tratados dos veces al día con 50 mg de sitagliptina abierta y metformina 1000 mg. En este grupo de pacientes, el valor medio de A1C basal fue del 11,2%, la FPG media fue de 314 mg / dL y la PPG promedio a las 2 horas fue de 441 mg / dL. Después de 24 semanas, se observaron disminuciones medias desde el inicio del -2,9% para A1C, -127 mg / dL para FPG y -208 mg / dL para PPG de 2 horas.
La terapia de combinación inicial o el mantenimiento de la terapia de combinación se deben individualizar y dejar a discreción del proveedor de atención médica.
Terapia complementaria con sitagliptina en pacientes con diabetes tipo 2 controlados inadecuadamente con metformina sola
Un total de 701 pacientes con diabetes tipo 2 participaron en un estudio aleatorizado, doble ciego, controlado con placebo de 24 semanas diseñado para evaluar la eficacia de sitagliptina en combinación con metformina. Los pacientes que ya estaban tomando metformina (N = 431) a una dosis de al menos 1500 mg por día fueron asignados al azar después de completar un período de preinclusión de placebo, ciego simple de 2 semanas. Pacientes con metformina y otro agente antihiperglucémico (N = 229) y pacientes sin ningún antihiperglucémico (sin tratamiento durante al menos 8 semanas, N = 41) fueron aleatorizados después de un período de preinclusión de aproximadamente 10 semanas con metformina (a una dosis de al menos 1500 mg por día) en monoterapia Los pacientes fueron asignados al azar a la adición de 100 mg de sitagliptina o placebo, administrados una vez al día. Los pacientes que no lograron alcanzar los objetivos glucémicos específicos durante los estudios fueron tratados con rescate de pioglitazona.
En combinación con metformina, la sitagliptina proporcionó mejoras significativas en A1C, FPG y PPG de 2 horas en comparación con el placebo con metformina (Tabla 4). La terapia glucémica de rescate se utilizó en el 5% de los pacientes tratados con 100 mg de sitagliptina y en el 14% de los pacientes tratados con placebo. Se observó una disminución similar en el peso corporal para ambos grupos de tratamiento.
Tabla 4: Parámetros glucémicos en la visita final (estudio de 24 semanas) de sitagliptina en terapia combinada complementaria con metformina *
| Sitagliptina 100 mg QD + Metformina |
Placebo + Metformina |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Línea de base (media) | 8.0 | 8.0 |
| Cambio desde el inicio (media ajustada†) | -0.7 | -0.0 |
| Diferencia con placebo + metformina (media ajustada†) (IC 95%) |
-0.7C (-0.8, -0.5) |
|
| Pacientes (%) que logran A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dL) | N = 454 | N = 226 |
| Línea de base (media) | 170 | 174 |
| Cambio desde el inicio (media ajustada†) | -17 | 9 |
| Diferencia con placebo + metformina (media ajustada†) (IC 95%) |
-25C (-31, -20) |
|
| PPG de 2 horas (mg / dL) | N = 387 | N = 182 |
| Línea de base (media) | 275 | 272 |
| Cambio desde el inicio (media ajustada†) | -62 | -11 |
| Diferencia con placebo + metformina (media ajustada†) (IC 95%) |
-51C (-61, -41) |
Tratamiento complementario con sitagliptina en pacientes con diabetes tipo 2 controlados de forma inadecuada en la combinación de metformina y glimepirida
Un total de 441 pacientes con diabetes tipo 2 participaron en un estudio aleatorizado, doble ciego, de 24 semanas. estudio controlado con placebo diseñado para evaluar la eficacia de sitagliptina en combinación con glimepirida, con o sin metformina Los pacientes ingresaron a un período de tratamiento inicial con glimepirida (4 mg por día) solo o glimepirida en combinación con metformina (1500 mg por día). Después de un período de ajuste de dosis y dosis estable de hasta 16 semanas y un período de prueba de placebo de 2 semanas, pacientes con insuficiencia El control glucémico (A1C 7.5% a 10.5%) se asignó al azar a la adición de 100 mg de sitagliptina o placebo, administrados una vez diario. Los pacientes que no lograron alcanzar los objetivos glucémicos específicos durante los estudios fueron tratados con rescate de pioglitazona.
Los pacientes que recibieron sitagliptina con metformina y glimepirida tuvieron mejoras significativas en A1C y FPG en comparación con los pacientes que recibieron placebo con metformina y glimepirida (Tabla 5), con reducciones medias desde el inicio con respecto al placebo en A1C de -0.9% y en FPG de -21 mg / dL. La terapia de rescate se utilizó en el 8% de los pacientes tratados con 100 mg de sitagliptina y en el 29% de los pacientes tratados con placebo adicional. Los pacientes tratados con sitagliptina complementaria tuvieron un aumento medio en el peso corporal de 1.1 kg vs. placebo adicional (+0.4 kg vs. -0,7 kg). Además, la sitagliptina complementaria dio como resultado una mayor tasa de hipoglucemia en comparación con el placebo complementario. [Ver Advertencias y precauciones; Reacciones adversas.]
Tabla 5: Parámetros glucémicos en la visita final (estudio de 24 semanas) para la sitagliptina en combinación con metformina y glimepirida *
| Sitagliptina 100 mg + Metformina y glimepirida |
Placebo + Metformina y glimepirida |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Línea de base (media) | 8.3 | 8.3 |
| Cambio desde el inicio (media ajustada†) | -0.6 | 0.3 |
| Diferencia con placebo (media ajustada†) (IC 95%) | -0.9C (-1.1, -0.7) |
|
| Pacientes (%) que logran A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dL) | N = 115 | N = 109 |
| Línea de base (media) | 179 | 179 |
| Cambio desde el inicio (media ajustada†) | -8 | 13 |
| Diferencia con placebo (media ajustada†) (IC 95%) | -21C (-32, -10) |
Terapia complementaria de sitagliptina vs. Terapia complementaria con glipizida en pacientes con diabetes tipo 2 con control inadecuado de metformina
La eficacia de la sitagliptina se evaluó en un ensayo de no inferioridad controlado por glipizida, doble ciego y de 52 semanas de duración en pacientes con diabetes tipo 2. Los pacientes que no están en tratamiento o con otros agentes antihiperglucémicos ingresaron en un período de tratamiento inicial de hasta 12 semanas de duración con monoterapia con metformina (dosis de â ‰ ¥ 1500 mg por día) que incluyó el lavado de medicamentos que no sean metformina, si aplicable. Después del período de preinclusión, aquellos con control glucémico inadecuado (A1C 6.5% a 10%) fueron aleatorizados 1: 1 a la adición de sitagliptina 100 mg una vez al día o glipizida durante 52 semanas. Los pacientes que recibieron glipizida recibieron una dosis inicial de 5 mg / día y luego se valoraron de forma electiva durante las siguientes 18 semanas a una dosis máxima de 20 mg / día según sea necesario para optimizar el control glucémico. A partir de entonces, la dosis de glipizida debía mantenerse constante, excepto la titulación descendente para prevenir la hipoglucemia. La dosis media de glipizida después del período de valoración fue de 10 mg.
Después de 52 semanas, la sitagliptina y la glipizida tuvieron reducciones medias similares al valor basal en A1C en el análisis por intención de tratar (Tabla 6). Estos resultados fueron consistentes con el análisis por protocolo (Figura 2). Una conclusión a favor de la no inferioridad de sitagliptina a glipizida puede limitarse a pacientes con valores basales A1C comparable a los incluidos en el estudio (más del 70% de los pacientes tenían A1C basal <8% y más del 90% tenían A1C <9%).
Tabla 6: Parámetros glucémicos en un estudio de 52 semanas que compara sitagliptina con glipizida como terapia complementaria en pacientes con control inadecuado de metformina (población con intención de tratar) *
| Sitagliptina 100 mg + Metformina |
Glipizida + Metformina |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Línea de base (media) | 7.7 | 7.6 |
| Cambio desde el inicio (media ajustada†) | -0.5 | -0.6 |
| FPG (mg / dL) | N = 583 | N = 568 |
| Línea de base (media) | 166 | 164 |
| Cambio desde el inicio (media ajustada†) | -8 | -8 |
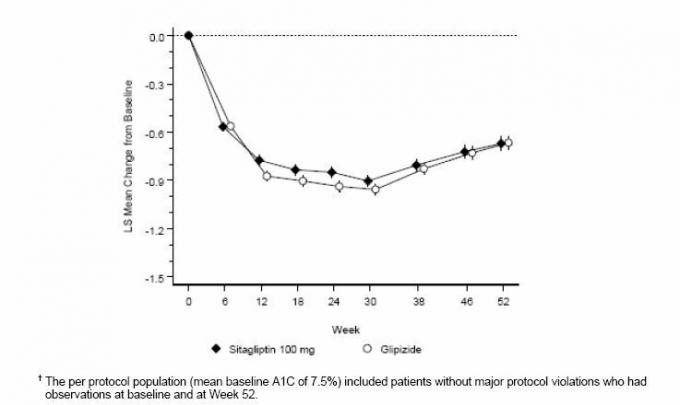
Figura 2: Cambio medio desde el inicio para A1C (%) durante 52 semanas en un estudio que compara sitagliptina con Glipizida como terapia complementaria en pacientes con control inadecuado de metformina (por población de protocolo) â€
La incidencia de hipoglucemia en el grupo de sitagliptina (4.9%) fue significativamente (p <0.001) menor que la del grupo de glipizida (32.0%). Los pacientes tratados con sitagliptina exhibieron una disminución media significativa desde el valor basal en el peso corporal en comparación con un aumento de peso significativo en los pacientes que recibieron glipizida (-1.5 kg vs. +1,1 kg).
parte superior
Cómo suministrado
No. 6747 - Tabletas Janumet, 50 mg / 500 mg, son tabletas recubiertas con película de color rosa claro, en forma de cápsula, con "575" grabado en una cara. Se suministran de la siguiente manera:
NDC 0006-0575-61 botellas de 60 unidades de uso
NDC 0006-0575-62 botellas de 180 unidades de uso
NDC 0006-0575-52 blister de dosis unitaria en paquetes de 50
NDC 0006-0575-82 botellas a granel de 1000.
No. 6749 - Tabletas Janumet, 50 mg / 1000 mg, son tabletas rojas, con forma de cápsula, recubiertas con película con "577" grabado en una cara. Se suministran de la siguiente manera:
NDC 0006-0577-61 botellas de 60 unidades de uso
NDC 0006-0577-62 botellas de unidad de uso de 180
NDC 0006-0577-52 blister de dosis unitaria en paquetes de 50
NDC 0006-0577-82 botellas a granel de 1000.
Almacene a 20-25 ° C (68-77 ° F), se permiten excursiones a 15-30 ° C (59-86 ° F).
parte superior
Información de asesoramiento para pacientes
Instrucciones
Se debe informar a los pacientes sobre los riesgos y beneficios potenciales de Janumet y sobre los modos alternativos de terapia. También deben ser informados sobre la importancia de cumplir con las instrucciones dietéticas, la actividad física regular, la sangre periódica monitoreo de glucosa y pruebas de A1C, reconocimiento y manejo de hipoglucemia e hiperglucemia, y evaluación de diabetes complicaciones Durante los períodos de estrés, como fiebre, trauma, infección o cirugía, los requisitos de medicación pueden cambiar y se debe recomendar a los pacientes que busquen atención médica de inmediato.
Los riesgos de acidosis láctica debido al componente de metformina, sus síntomas y las condiciones que predisponen a su desarrollo, como se señala en Advertencias y precauciones, debe explicarse a los pacientes. Se debe aconsejar a los pacientes que interrumpan Janumet de inmediato y que notifiquen inmediatamente a su profesional de la salud en caso de hiperventilación inexplicada, mialgia, malestar general, somnolencia inusual, mareos, latidos cardíacos lentos o irregulares, sensación de frío (especialmente en las extremidades) u otros síntomas inespecíficos ocurrir. Los síntomas gastrointestinales son comunes durante el inicio del tratamiento con metformina y pueden ocurrir durante el inicio del tratamiento con Janumet; sin embargo, los pacientes deben consultar a su médico si desarrollan síntomas inexplicables. Aunque es poco probable que los síntomas gastrointestinales que ocurren después de la estabilización estén relacionados con las drogas, tal la aparición de síntomas debe evaluarse para determinar si puede deberse a acidosis láctica u otra enfermedad grave enfermedad.
Se debe aconsejar a los pacientes contra el consumo excesivo de alcohol, ya sea agudo o crónico, mientras reciben Janumet.
Se debe informar a los pacientes sobre la importancia de realizar pruebas periódicas de la función renal y los parámetros hematológicos al recibir tratamiento con Janumet.
Se debe informar a los pacientes que se han informado reacciones alérgicas durante el uso posterior a la comercialización de sitagliptina, uno de los componentes de Janumet. Si los síntomas de reacciones alérgicas (como erupción cutánea, urticaria e hinchazón de la cara, labios, lengua y garganta que pueden causar dificultad para respirar o tragar), los pacientes deben dejar de tomar Janumet y consultar a un médico prontamente.
Los médicos deben indicar a sus pacientes que lean el prospecto del paquete del paciente antes de comenzar la terapia con Janumet y que lo vuelvan a leer cada vez que se renueve la receta. Se debe indicar a los pacientes que informen a su médico o farmacéutico si desarrollan algún síntoma inusual o si algún síntoma conocido persiste o empeora.
Pruebas de laboratorio
La respuesta a todas las terapias para diabéticos debe controlarse mediante mediciones periódicas de los niveles de glucosa en sangre y A1C, con el objetivo de disminuir estos niveles hacia el rango normal. A1C es especialmente útil para evaluar el control glucémico a largo plazo.
Monitoreo inicial y periódico de parámetros hematológicos (p. Ej., Hemoglobina / hematocrito y sangre roja índices celulares) y la función renal (creatinina sérica) deben realizarse, al menos una vez al año. Si bien raramente se ha observado anemia megaloblástica con el tratamiento con metformina, si se sospecha esto, se debe excluir la deficiencia de vitamina B12.
DISTRIBUIDO por:
MERCK & CO., INC., Whitehouse Station, NJ 08889, EE. UU.
9794108
Patente de EE. UU. No: 6,699,871
1 Marca registrada de MERCK & CO., Inc., Whitehouse Station, Nueva Jersey 08889 EE. UU.
2 Marca registrada de MERCK & CO., Inc., Whitehouse Station, Nueva Jersey 08889 EE. UU.
3GLUCOPHAGE® es una marca registrada de Merck Sante S.A.S, un asociado de Merck KGaA de Darmstadt, Alemania.
Con licencia para Bristol-Myers Squibb Company.
DERECHOS DE AUTOR © 2007, 2008 MERCK & CO., Inc.
Todos los derechos reservados
Etiquetado de pacientes aprobado por la FDA
Información del paciente
Janumet® (JAN-te conociste)
(sitagliptina / metformina HCl)
Tabletas
Lea la Información del paciente que viene con Janumet1 antes de comenzar a tomarla y cada vez que renueve su receta. Es posible que haya nueva información. Este folleto no reemplaza la consulta con su médico sobre su afección médica o tratamiento.
¿Cuál es la información más importante que debo saber sobre Janumet?
El clorhidrato de metformina, uno de los ingredientes en Janumet, puede causar un efecto secundario raro pero grave llamado acidosis láctica (una acumulación de ácido láctico en la sangre) que puede causar la muerte. La acidosis láctica es una emergencia médica y debe tratarse en un hospital.
Deje de tomar Janumet y llame a su médico de inmediato si presenta alguno de los siguientes síntomas de acidosis láctica:
- Te sientes muy débil y cansado.
- Tiene dolor muscular inusual (no normal).
- Tienes problemas para respirar.
- Tiene problemas estomacales o intestinales inexplicables con náuseas y vómitos, o diarrea.
- Sientes frío, especialmente en tus brazos y piernas.
- Te sientes mareado o aturdido.
- Tiene latidos cardíacos lentos o irregulares.
Tiene una mayor probabilidad de contraer acidosis láctica si:
- Tiene problemas renales.
- tiene problemas de hígado
- tiene insuficiencia cardíaca congestiva que requiere tratamiento con medicamentos.
- beba mucho alcohol (muy a menudo o bebe "atracones" a corto plazo).
- deshidratarse (perder una gran cantidad de fluidos corporales). Esto puede suceder si tiene fiebre, vómitos o diarrea. La deshidratación también puede ocurrir cuando suda mucho con actividad o ejercicio y no bebe suficientes líquidos.
- someterse a ciertas pruebas de rayos X con colorantes inyectables o agentes de contraste.
- tener cirugia.
- tiene un ataque al corazón, infección grave o accidente cerebrovascular.
- tiene 80 años de edad o más y no le han hecho una prueba de función renal.
¿Qué es Janumet?
Las tabletas Janumet contienen dos medicamentos recetados, sitagliptina (JANUVIA ™ 2) y metformina. Janumet puede usarse junto con dieta y ejercicio para reducir el azúcar en sangre en pacientes adultos con diabetes tipo 2. Su médico determinará si Janumet es adecuado para usted y determinará la mejor manera de comenzar y continuar tratando su diabetes.
Janumet:
- Ayuda a mejorar los niveles de insulina después de una comida.
- Ayuda al cuerpo a responder mejor a la insulina que produce naturalmente.
- Disminuye la cantidad de azúcar producida por el cuerpo.
- es poco probable que cause niveles bajos de azúcar en la sangre (hipoglucemia) cuando se toma solo para tratar el nivel alto de azúcar en la sangre.
Janumet no se ha estudiado en niños menores de 18 años.
Janumet no se ha estudiado con insulina, un medicamento que se sabe que causa niveles bajos de azúcar en la sangre.
¿Quién no debe tomar Janumet?
No tome Janumet si usted:
- tiene diabetes tipo 1
- tiene ciertos problemas renales.
- tiene afecciones llamadas acidosis metabólica o cetoacidosis diabética (aumento de cetonas en la sangre o la orina).
- ha tenido una reacción alérgica a Janumet o sitagliptina (JANUVIA), uno de los componentes de Janumet.
- van a recibir una inyección de tinte o agentes de contraste para un procedimiento de rayos X, Janumet deberá suspenderse por un corto tiempo. Hable con su médico acerca de cuándo detener Janumet y cuándo comenzar de nuevo. Consulte "¿Cuál es la información más importante que debo saber sobre Janumet?"
¿Qué debo decirle a mi médico antes y durante el tratamiento con Janumet?
Janumet puede no ser adecuado para usted. Informe a su médico sobre todas sus afecciones médicas, incluso si usted:
- Tiene problemas renales.
- tiene problemas de hígado
- ha tenido una reacción alérgica a Janumet o sitagliptina (JANUVIA), uno de los componentes de Janumet.
- tiene problemas cardíacos, incluida insuficiencia cardíaca congestiva.
- son mayores de 80 años. Los pacientes mayores de 80 años no deben tomar Janumet a menos que se verifique su función renal y sea normal.
- beba mucho alcohol (todo el tiempo o consumo excesivo de alcohol a corto plazo).
- está embarazada o planea quedar embarazada. No se sabe si Janumet dañará a su bebé nonato. Si está embarazada, hable con su médico sobre la mejor manera de controlar su azúcar en la sangre mientras está embarazada. Si usa Janumet durante el embarazo, hable con su médico sobre cómo puede estar en el registro de Janumet. El número de teléfono gratuito para el registro de embarazos es 1-800-986-8999.
- está amamantando o planea amamantar. No se sabe si Janumet pasará a la leche materna. Hable con su médico sobre la mejor manera de alimentar a su bebé si está tomando Janumet.
Dígale a su médico acerca de todos los medicamentos que toma, incluidos los medicamentos recetados y sin receta, vitaminas y suplementos herbales. Janumet puede afectar la eficacia de otras drogas y algunas drogas pueden afectar la eficacia de Janumet.
Conozca los medicamentos que toma. Mantenga una lista de sus medicamentos y muéstresela a su médico y farmacéutico cuando obtenga un medicamento nuevo. Hable con su médico antes de comenzar cualquier medicamento nuevo.
¿Cómo debo tomar Janumet?
- Su médico le dirá cuántas tabletas de Janumet debe tomar y con qué frecuencia debe tomarlas. Tome Janumet exactamente como le indique su médico.
- Es posible que su médico necesite aumentar su dosis para controlar su azúcar en la sangre.
- Su médico puede recetarle Janumet junto con una sulfonilurea (otro medicamento para bajar el azúcar en la sangre). Consulte "¿Cuáles son los posibles efectos secundarios de Janumet?" para obtener información sobre un mayor riesgo de niveles bajos de azúcar en la sangre.
- Tome Janumet con las comidas para reducir la posibilidad de malestar estomacal.
- Continúe tomando Janumet mientras su médico le indique.
- Si toma demasiado Janumet, llame a su médico o al centro de control de intoxicaciones de inmediato.
- Si olvida una dosis, tómela con comida tan pronto como lo recuerde. Si no recuerda hasta la hora de su próxima dosis, omita la dosis omitida y vuelva a su horario habitual. No tome dos dosis de Janumet al mismo tiempo.
- Es posible que deba dejar de tomar Janumet por un corto tiempo. Llame a su médico para obtener instrucciones si usted:
- están deshidratados (han perdido demasiado líquido corporal). La deshidratación puede ocurrir si está enfermo con vómitos intensos, diarrea o fiebre, o si bebe mucho menos líquido de lo normal.
- plan para operarse.
- recibirán una inyección de tinte o agente de contraste para un procedimiento de rayos X.
Consulte "¿Cuál es la información más importante que debo saber sobre Janumet?" y "¿Quién no debe tomar Janumet?"
- Cuando su cuerpo está bajo algunos tipos de estrés, como fiebre, trauma (como un accidente automovilístico), infección o cirugía, la cantidad de medicamentos para la diabetes que necesita puede cambiar. Informe a su médico de inmediato si tiene alguna de estas condiciones y siga las instrucciones de su médico.
- Controle su nivel de azúcar en la sangre como le indique su médico.
- Siga su dieta prescrita y su programa de ejercicios mientras toma Janumet.
- Hable con su médico sobre cómo prevenir, reconocer y controlar el bajo nivel de azúcar en la sangre (hipoglucemia), el nivel alto de azúcar en la sangre (hiperglucemia) y las complicaciones de la diabetes.
- Su médico controlará su diabetes con análisis de sangre periódicos, incluidos sus niveles de azúcar en la sangre y su hemoglobina A1C.
- Su médico le realizará análisis de sangre para verificar su función renal antes y durante el tratamiento con Janumet.
¿Cuáles son los posibles efectos secundarios de Janumet?
Janumet puede causar efectos secundarios graves. Consulte "¿Cuál es la información más importante que debo saber sobre Janumet?"
Los efectos secundarios comunes al tomar Janumet incluyen:
- nariz tapada o que gotea y dolor de garganta
- infeccion de las vias respiratorias altas
- Diarrea
- náuseas y vómitos
- gases, malestar estomacal, indigestión
- debilidad
- dolor de cabeza
Tomar Janumet con las comidas puede ayudar a reducir los efectos secundarios estomacales comunes de la metformina que generalmente ocurren al comienzo del tratamiento. Si tiene problemas estomacales inusuales o inesperados, hable con su médico. Los problemas estomacales que comienzan más tarde durante el tratamiento pueden ser un signo de algo más grave.
Ciertos medicamentos para la diabetes, como las sulfonilureas y las meglitinidas, pueden causar niveles bajos de azúcar en la sangre (hipoglucemia). Cuando Janumet se usa con estos medicamentos, puede tener niveles de azúcar en la sangre demasiado bajos. Su médico puede recetarle dosis más bajas de sulfonilurea o meglitinida. Informe a su médico si tiene problemas con un nivel bajo de azúcar en la sangre.
Se han informado los siguientes efectos secundarios adicionales en uso general con Janumet o sitagliptina:
- Pueden ocurrir reacciones alérgicas graves con Janumet o sitagliptina, uno de los medicamentos en Janumet. Los síntomas de una reacción alérgica grave pueden incluir erupción cutánea, urticaria e hinchazón de la cara, labios, lengua y garganta, dificultad para respirar o tragar. Si tiene una reacción alérgica, deje de tomar Janumet y llame a su médico de inmediato. Su médico puede recetarle un medicamento para tratar su reacción alérgica y un medicamento diferente para su diabetes.
- Elevación de las enzimas hepáticas.
- Inflamación del páncreas.
Estos no son todos los posibles efectos secundarios de Janumet. Para más información, consulte a su médico.
Informe a su médico si tiene algún efecto secundario que le moleste, sea inusual o no desaparezca.
¿Cómo debo guardar Janumet?
Guarde Janumet a temperatura ambiente, 68-77 ° F (20-25 ° C).
Mantenga Janumet y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso de Janumet
Algunas veces se recetan medicamentos para afecciones que no se mencionan en los folletos de información para el paciente. No use Janumet para una afección para la cual no fue recetado. No le dé Janumet a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede dañarlos.
Este folleto resume la información más importante sobre Janumet. Si desea obtener más información, hable con su médico. Puede pedirle a su médico o farmacéutico información sobre Janumet escrita para profesionales de la salud. Para más información llame al 1-800-622-4477.
¿Cuáles son los ingredientes en Janumet?
Ingredientes activos: sitagliptina y clorhidrato de metformina.
Ingredientes inactivos: celulosa microcristalina, polivinilpirrolidona, lauril sulfato de sodio y estearil fumarato de sodio. El recubrimiento de película de la tableta contiene los siguientes ingredientes inactivos: alcohol polivinílico, polietilenglicol, talco, dióxido de titanio, óxido de hierro rojo y óxido de hierro negro.
¿Qué es la diabetes tipo 2?
La diabetes tipo 2 es una condición en la cual su cuerpo no produce suficiente insulina, y la insulina que produce su cuerpo no funciona tan bien como debería. Su cuerpo también puede producir demasiada azúcar. Cuando esto sucede, el azúcar (glucosa) se acumula en la sangre. Esto puede conducir a problemas médicos graves.
El objetivo principal del tratamiento de la diabetes es reducir el azúcar en la sangre a un nivel normal. Bajar y controlar el azúcar en la sangre puede ayudar a prevenir o retrasar las complicaciones de la diabetes, como problemas cardíacos, problemas renales, ceguera y amputación.
El nivel alto de azúcar en la sangre puede reducirse con dieta y ejercicio, y con ciertos medicamentos cuando sea necesario.
Emitido en marzo de 2009
DISTRIBUIDO por:
MERCK & CO., INC., Whitehouse Station, NJ 08889, EE. UU.
Última actualización: 03/09
Janumet, clorhidrato de sitagliptina y metformina, información para el paciente (en inglés simple)
Información detallada sobre signos, síntomas, causas, tratamientos de diabetes
La información de esta monografía no pretende abarcar todos los usos, instrucciones, precauciones, interacciones farmacológicas o efectos adversos posibles. Esta información es generalizada y no pretende ser un consejo médico específico. Si tiene preguntas sobre los medicamentos que está tomando o desea obtener más información, consulte con su médico, farmacéutico o enfermero.
de regreso: Ver todos los medicamentos para la diabetes



