Iloperidona (fanapt) Información de prescripción completa
Nombre de la marca: Fanapt
Nombre genérico: Iloperidona
Guía de prescripción de Fanapt (Iloperidona) (PDF)
Contenido:
Advertencia en caja
Indicaciones y uso
Dosificación y administración
Contraindicaciones
Advertencias y precauciones
Reacciones adversas
Interacciones con la drogas
Uso en poblaciones específicas
Abuso y dependencia de drogas
Sobredosis
Descripción
Farmacología Clínica
Toxicología no clínica
Estudios clínicos
Cómo suministrado
Guía de medicamentos Brintellix
ADVERTENCIA: MAYOR MORTALIDAD EN PACIENTES MAYORES CON PSICOSIS RELACIONADA CON LA DEMENCIA
Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con fármacos antipsicóticos tienen un mayor riesgo de muerte. FANAPT no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia.
Indicaciones y uso
FANAPT® está indicado para el tratamiento de la esquizofrenia en adultos.
Al decidir entre los tratamientos alternativos disponibles para esta afección, el prescriptor debe considerar el hallazgo de que FANAPT está asociado con la prolongación del intervalo QTc. La prolongación del intervalo QTc se asocia en algunas otras drogas con la capacidad de causar torsade de arritmia de tipo pointes, una taquicardia ventricular polimórfica potencialmente mortal que puede provocar muerte. En muchos casos, esto llevaría a la conclusión de que otras drogas deben probarse primero. Todavía no se sabe si FANAPT causará torsade de pointes o aumentará la tasa de muerte súbita.
Los pacientes deben ser titulados a una dosis efectiva de FANAPT. Por lo tanto, el control de los síntomas puede retrasarse durante las primeras 1 a 2 semanas de tratamiento en comparación con otros medicamentos antipsicóticos que no requieren una valoración similar. Los prescriptores deben tener en cuenta este retraso al seleccionar un medicamento antipsicótico para el tratamiento de la esquizofrenia.
continuar la historia a continuación
Dosificación y administración
Dosis usual
FANAPT debe ajustarse lentamente a partir de una dosis inicial baja para evitar la hipotensión ortostática debido a sus propiedades de bloqueo alfa-adrenérgico. La dosis inicial recomendada para las tabletas de FANAPT es de 1 mg por vía oral dos veces al día. Se puede aumentar la dosis para alcanzar el rango objetivo de 6-12 mg dos veces al día (12_24 mg / día) con ajustes de dosis diarios que no excedan de 2 mg dos veces al día (4 mg / día). La dosis máxima recomendada es de 12 mg dos veces al día (24 mg / día). Las dosis de FANAPT superiores a 24 mg / día no se han evaluado sistemáticamente en los ensayos clínicos. La eficacia se demostró con FANAPT en un rango de dosis de 6 a 12 mg dos veces al día. Los prescriptores deben tener en cuenta el hecho de que los pacientes deben ajustarse a una dosis efectiva de FANAPT. Por lo tanto, el control de los síntomas puede retrasarse durante las primeras 1 a 2 semanas de tratamiento en comparación con otros medicamentos antipsicóticos que no requieren una valoración similar. Los prescriptores también deben saber que algunos efectos adversos asociados con el uso de FANAPT están relacionados con la dosis. FANAPT puede administrarse sin tener en cuenta las comidas.
Dosis en poblaciones especiales
Ajuste de la dosis para pacientes que toman FANAPT concomitantemente con posibles inhibidores de CYP2D6: la dosis de FANAPT debe ser reducido a la mitad cuando se administra concomitantemente con inhibidores potentes de CYP2D6 como fluoxetina o paroxetina. Cuando el inhibidor de CYP2D6 se retira de la terapia de combinación, la dosis de FANAPT se debe aumentar a donde estaba antes.
Ajuste de la dosis para pacientes que toman FANAPT concomitantemente con posibles inhibidores de CYP3A4: la dosis de FANAPT debe ser reducido a la mitad cuando se administra concomitantemente con inhibidores potentes de CYP3A4 como ketoconazol o claritromicina Cuando el inhibidor de CYP3A4 se retira de la terapia de combinación, la dosis de FANAPT se debe aumentar a donde estaba antes.
Ajuste de la dosis para pacientes que toman FANAPT que son metabolizadores lentos de CYP2D6: la dosis de FANAPT debe reducirse a la mitad para los metabolizadores lentos de CYP2D6.
Insuficiencia hepática: no es necesario ajustar la dosis de FANAPT en pacientes con insuficiencia hepática leve. Los pacientes con insuficiencia hepática moderada pueden requerir una reducción de la dosis, si está clínicamente indicado. FANAPT no se recomienda para pacientes con insuficiencia hepática grave.
Tratamiento de mantenimiento
En un estudio a más largo plazo, FANAPT fue eficaz para retrasar el tiempo de recaída en pacientes con esquizofrenia que se estabilizaron con FANAPT hasta 24 mg / día. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento.
Reinicio del tratamiento en pacientes previamente descontinuados, aunque no hay datos para abordar específicamente el reinicio de tratamiento, se recomienda seguir el programa de titulación de iniciación cada vez que los pacientes hayan tenido un intervalo de más de FANAPT De 3 días.
parte superior
Formas de dosificación y fortalezas
Los comprimidos de FANAPT están disponibles en las siguientes dosis: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg y 12 mg. Las tabletas son blancas, redondas, planas, con bordes biselados e identificadas con el logotipo "" grabado en un lado y la resistencia de la tableta "1", "2", "4", "6", "8", "10", o "12" grabado en el otro lado.
parte superior
Contraindicaciones
FANAPT está contraindicado en individuos con una reacción de hipersensibilidad conocida al producto. Se han reportado anafilaxia, angioedema y otras reacciones de hipersensibilidad.
parte superior
ADVERTENCIAS Y PRECAUCIONES
Aumento de la mortalidad en pacientes de edad avanzada con psicosis relacionada con la demencia
Los fármacos antipsicóticos aumentan el riesgo de muerte por todas las causas en pacientes de edad avanzada con psicosis relacionada con la demencia. Análisis de 17 ensayos controlados con placebo de psicosis relacionada con la demencia (duración modal de 10 semanas y principalmente en pacientes que toman atípicos fármacos antipsicóticos) revelaron un riesgo de muerte en los pacientes tratados con drogas de entre 1,6 y 1,7 veces mayor que en los pacientes tratados con placebo. En el transcurso de un ensayo controlado típico de 10 semanas, la tasa de mortalidad en pacientes tratados con medicamentos fue de aproximadamente 4.5%, en comparación con una tasa de aproximadamente 2.6% en pacientes tratados con placebo.
Aunque las causas de muerte fueron variadas, la mayoría de las muertes parecen ser de naturaleza cardiovascular (por ejemplo, insuficiencia cardíaca, muerte súbita) o infecciosa (por ejemplo, neumonía). FANAPT no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia.
Reacciones adversas cerebrovasculares, incluido accidente cerebrovascular, en pacientes de edad avanzada con psicosis relacionada con la demencia
En ensayos controlados con placebo en sujetos de edad avanzada con demencia, pacientes asignados al azar a risperidona, El aripiprazol y la olanzapina tuvieron una mayor incidencia de accidente cerebrovascular y ataque isquémico transitorio, incluso mortal. carrera. FANAPT no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia.
Prolongación QT
En un estudio abierto de QTc en pacientes con esquizofrenia o trastorno esquizoafectivo (n = 160), FANAPT se asoció con una prolongación de QTc de 9 ms a una dosis de iloperidona de 12 mg dos veces al día. El efecto de FANAPT sobre el intervalo QT se incrementó por la presencia de inhibición metabólica CYP450 2D6 o 3A4 (paroxetina 20 mg una vez al día y ketoconazol 200 mg dos veces al día, respectivamente). En condiciones de inhibición metabólica para 2D6 y 3A4, FANAPT 12 mg dos veces al día se asoció con un aumento medio de QTcF desde el inicio de aproximadamente 19 mseg.
No se observaron casos de torsade de pointes u otras arritmias cardíacas graves durante el programa clínico previo a la comercialización.
Se debe evitar el uso de FANAPT en combinación con otros medicamentos que se sabe que prolongan el QTc, incluida la Clase 1A (por ejemplo, quinidina, procainamida) o medicamentos antiarrítmicos de clase III (p. ej., amiodarona, sotalol), antipsicóticos (p. ej., clorpromazina, tioridazina), antibióticos (por ejemplo, gatifloxacina, moxifloxacina), o cualquier otra clase de medicamentos que se sepa que prolongan el intervalo QTc (por ejemplo, pentamidina, acetato de levometadilo, metadona). FANAPT también debe evitarse en pacientes con síndrome de QT largo congénito y en pacientes con antecedentes de arritmias cardíacas.
Ciertas circunstancias pueden aumentar el riesgo de torsade de pointes y / o muerte súbita en asociación con el uso de medicamentos que prolongan el intervalo QTc, incluyendo (1) bradicardia; (2) hipocalemia o hipomagnesemia; (3) uso concomitante de otras drogas que prolongan el intervalo QTc; y (4) presencia de prolongación congénita del intervalo QT; (5) infarto agudo de miocardio reciente; y / o (6) insuficiencia cardíaca no compensada.
Se recomienda precaución cuando se prescribe FANAPT con medicamentos que inhiben el metabolismo de FANAPT, y en pacientes con actividad reducida de CYP2D6.
Se recomienda que los pacientes considerados para el tratamiento con FANAPT estén en riesgo de sufrir Las alteraciones electrolíticas tienen mediciones séricas basales de potasio y magnesio con periodicidad periódica. supervisión. La hipocalemia (y / o hipomagnesemia) puede aumentar el riesgo de prolongación del intervalo QT y arritmia. FANAPT debería evitarse en pacientes con antecedentes de enfermedad cardiovascular significativa, por ejemplo, QT prolongación, infarto agudo de miocardio reciente, insuficiencia cardíaca no compensada o arritmia cardíaca. FANAPT debe suspenderse en pacientes con mediciones persistentes de QTc> 500 mseg.
Si los pacientes que toman FANAPT experimentan síntomas que podrían indicar la aparición de arritmias cardíacas, por ejemplo, mareos, palpitaciones o síncope, el prescriptor debe iniciar una evaluación adicional, incluso cardíaca supervisión.
Síndrome Neuroléptico Maligno (SNM)
Se ha informado de un complejo de síntomas potencialmente fatales, a veces denominado Síndrome Neuroléptico Maligno (SNM) en asociación con la administración de fármacos antipsicóticos, incluido FANAPT. Las manifestaciones clínicas incluyen hiperpirexia, rigidez muscular, estado mental alterado (incluidos signos catatónicos) y evidencia de inestabilidad autonómica (pulso irregular o presión sanguínea, taquicardia, diaforesis y enfermedad cardíaca disritmia). Los signos adicionales pueden incluir creatina fosfoquinasa elevada, mioglobinuria (rabdomiólisis) e insuficiencia renal aguda. La evaluación diagnóstica de pacientes con este síndrome es complicada. Para llegar a un diagnóstico, es importante identificar los casos en los que la presentación clínica incluye tanto enfermedades médicas graves como signos y síntomas extrapiramidales no tratados o tratados inadecuadamente (EPS). Otras consideraciones importantes en el diagnóstico diferencial incluyen toxicidad anticolinérgica central, golpe de calor, fiebre del fármaco y patología primaria del sistema nervioso central (SNC).
El tratamiento de este síndrome debe incluir: (1) interrupción inmediata de los fármacos antipsicóticos y otros fármacos que no son esenciales para la terapia concurrente, (2) tratamiento sintomático intensivo y monitoreo médico, y (3) tratamiento de cualquier problema médico grave concomitante para el que haya tratamientos específicos disponibles. No existe un acuerdo general sobre los regímenes de tratamiento farmacológico específico para el SNM.
Si un paciente requiere tratamiento con medicamentos antipsicóticos después de la recuperación del SNM, se debe considerar cuidadosamente la posible reintroducción de la terapia con medicamentos. El paciente debe ser monitoreado cuidadosamente, ya que se han reportado recurrencias de NMS.
Discinesia tardía
La discinesia tardía es un síndrome que consiste en movimientos discinéticos potencialmente irreversibles, involuntarios, que pueden desarrollarse en pacientes tratados con fármacos antipsicóticos. Aunque la prevalencia del síndrome parece ser más alta entre los ancianos, especialmente las mujeres de edad avanzada, es imposible confiar en las estimaciones de prevalencia para predecir, al inicio del tratamiento antipsicótico, qué pacientes tienen probabilidades de desarrollar síndrome. Se desconoce si los medicamentos antipsicóticos difieren en su potencial para causar discinesia tardía.
Se cree el riesgo de desarrollar discinesia tardía y la probabilidad de que se vuelva irreversible. aumentar a medida que dura el tratamiento y la dosis acumulada total de antipsicótico administrado aumenta Sin embargo, el síndrome puede desarrollarse, aunque con mucha menos frecuencia, después de períodos de tratamiento relativamente breves a dosis bajas.
No existe un tratamiento conocido para los casos establecidos de discinesia tardía, aunque el síndrome puede remitir, parcial o completamente, si se retira el tratamiento antipsicótico. Sin embargo, el tratamiento antipsicótico en sí mismo puede suprimir (o suprimir parcialmente) los signos y síntomas del síndrome y, por lo tanto, puede enmascarar el proceso subyacente. Se desconoce el efecto que tiene la supresión sintomática sobre el curso a largo plazo del síndrome.
Dadas estas consideraciones, FANAPT debe prescribirse de una manera que sea más probable que minimice la aparición de discinesia tardía. El tratamiento antipsicótico crónico generalmente debe reservarse para pacientes que padecen una enfermedad crónica a la que (1) se sabe que responde medicamentos antipsicóticos, y (2) para quienes tratamientos alternativos, igualmente efectivos, pero potencialmente menos dañinos, no están disponibles o apropiado. En pacientes que requieren tratamiento crónico, se debe buscar la dosis más pequeña y la duración más corta del tratamiento que produzca una respuesta clínica satisfactoria. La necesidad de continuar el tratamiento debe reevaluarse periódicamente.
Si aparecen signos y síntomas de discinesia tardía en un paciente con FANAPT, se debe considerar la interrupción del medicamento. Sin embargo, algunos pacientes pueden requerir tratamiento con FANAPT a pesar de la presencia del síndrome.
Cambios metabólicos
Los fármacos antipsicóticos atípicos se han asociado con cambios metabólicos que pueden aumentar el riesgo cardiovascular / cerebrovascular. Estos cambios metabólicos incluyen hiperglucemia, dislipidemia y aumento de peso corporal. Si bien se ha demostrado que todos los fármacos antipsicóticos atípicos producen algunos cambios metabólicos, cada fármaco de su clase tiene su propio perfil de riesgo específico.
Hiperglucemia y diabetes mellitus
Se ha notificado hiperglucemia, en algunos casos extrema y asociada con cetoacidosis o coma hiperosmolar o muerte, en pacientes tratados con antipsicóticos atípicos, incluido FANAPT. La evaluación de la relación entre el uso de antipsicóticos atípicos y las anormalidades de glucosa se complica por la posibilidad de un aumento antecedentes de riesgo de diabetes mellitus en pacientes con esquizofrenia y la creciente incidencia de diabetes mellitus en general población. Dados estos factores de confusión, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con la hiperglucemia no se comprende completamente. Sin embargo, los estudios epidemiológicos sugieren un mayor riesgo de eventos adversos relacionados con la hiperglucemia en pacientes tratados con los antipsicóticos atípicos incluidos en estos estudios.
Los pacientes con un diagnóstico establecido de diabetes mellitus que se inician con antipsicóticos atípicos deben controlarse regularmente para detectar un empeoramiento del control de la glucosa. Pacientes con factores de riesgo de diabetes mellitus (p. Ej., Obesidad, antecedentes familiares de diabetes) que están comenzando el tratamiento con los antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas al comienzo del tratamiento y periódicamente durante tratamiento. Cualquier paciente tratado con antipsicóticos atípicos debe ser monitoreado para detectar síntomas de hiperglucemia, incluyendo polidipsia, poliuria, polifagia y debilidad. Los pacientes que desarrollan síntomas de hiperglucemia durante el tratamiento con antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas. En algunos casos, la hiperglucemia se resolvió cuando se suspendió el antipsicótico atípico; sin embargo, algunos pacientes requirieron la continuación del tratamiento antidiabético a pesar de la interrupción del fármaco sospechoso.
Los datos de un estudio de dosis fija de 4 semanas en sujetos adultos con esquizofrenia, en el que se extrajeron muestras de sangre en ayunas, se presentan en la Tabla 1.
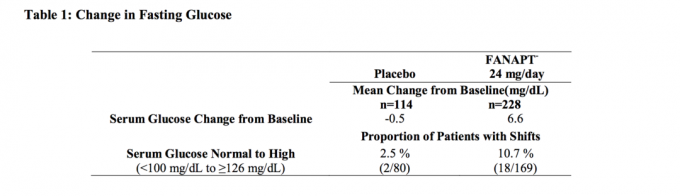
Los análisis agrupados de datos de glucosa de estudios clínicos que incluyen ensayos a más largo plazo se muestran en la Tabla 2.
Dislipidemia
Se han observado alteraciones indeseables en los lípidos en pacientes tratados con antipsicóticos atípicos.
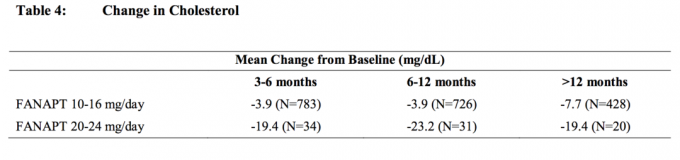
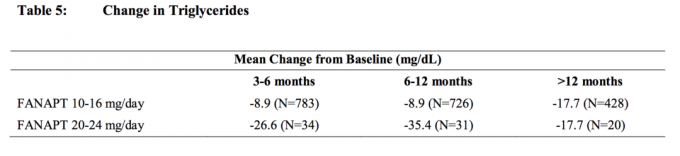
Los datos de un estudio de dosis fija de 4 semanas controlado con placebo, en el que se extrajeron muestras de sangre en ayunas, en sujetos adultos con esquizofrenia se presentan en la Tabla 3.

Los análisis agrupados de los datos de colesterol y triglicéridos de estudios clínicos que incluyen ensayos a más largo plazo se muestran en la Tabla 4 y la Tabla 5.
Aumento de peso
Se ha observado aumento de peso con el uso de antipsicóticos atípicos. Se recomienda la monitorización clínica del peso.
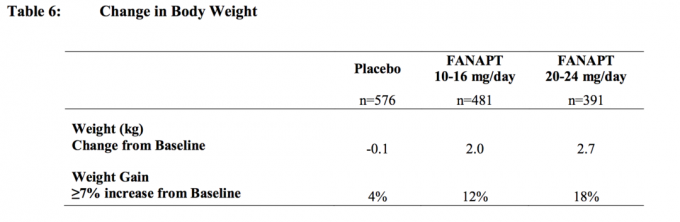
En todos los estudios a corto y largo plazo, el cambio medio general desde el inicio hasta el punto final fue de 2,1 kg.
Cambios en el peso corporal (kg) y la proporción de sujetos con un aumento del peso corporal ≥7% de 4 Los estudios controlados con placebo, de 4 o 6 semanas, de dosis fija o flexible en sujetos adultos se presentan en Tabla 6.
Convulsiones
En los ensayos controlados con placebo a corto plazo (de 4 a 6 semanas), se produjeron convulsiones en el 0.1% (1/1344) de los pacientes tratados con FANAPT en comparación con el 0.3% (2/587) con placebo. Al igual que con otros antipsicóticos, FANAPT debe usarse con precaución en pacientes con antecedentes de convulsiones o con afecciones que potencialmente reducen el umbral de convulsiones. Las condiciones que reducen el umbral de convulsiones pueden ser más frecuentes en una población de 65 años o más.
Hipotensión Ortostática y Síncope
FANAPT puede inducir hipotensión ortostática asociada con mareos, taquicardia y síncope. Esto refleja sus propiedades antagonistas adrenérgicas alfa1. En estudios doble ciego controlados con placebo a corto plazo, donde la dosis se incrementó lentamente, según lo recomendado arriba, se informó síncope en el 0,4% (5/1344) de los pacientes tratados con FANAPT, en comparación con el 0,2% (1/587) en placebo. Se informó hipotensión ortostática en el 5% de los pacientes que recibieron 20-24 mg / día, el 3% de los pacientes que recibieron 10-16 mg / día y el 1% de los pacientes que recibieron placebo. Se esperaría una titulación más rápida para aumentar la tasa de hipotensión ortostática y síncope.
FANAPT debe usarse con precaución en pacientes con enfermedad cardiovascular conocida (por ejemplo, insuficiencia cardíaca, antecedentes de infarto de miocardio, isquemia o conducción) anomalías), enfermedad cerebrovascular o afecciones que predisponen al paciente a la hipotensión (deshidratación, hipovolemia y tratamiento con antihipertensivos medicamentos). Se debe considerar la monitorización de los signos vitales ortostáticos en pacientes que son vulnerables a la hipotensión.
Leucopenia, Neutropenia y Agranulocitosis
En los ensayos clínicos y la experiencia posterior a la comercialización, se han informado eventos de leucopenia / neutropenia relacionados temporalmente con agentes antipsicóticos. También se ha informado de agranulocitosis (incluidos casos fatales).
Los posibles factores de riesgo de leucopenia / neutropenia incluyen un recuento bajo de glóbulos blancos (WBC) preexistente y antecedentes de leucopenia / neutropenia inducida por fármacos. Los pacientes con un bajo recuento de glóbulos blancos o antecedentes de leucopenia / neutropenia inducida por fármacos deben controlar su recuento sanguíneo completo (CBC) con frecuencia durante los primeros meses de tratamiento y debe interrumpir FANAPT a la primera señal de una disminución en el WBC en ausencia de otras causas factores
Los pacientes con neutropenia deben controlarse cuidadosamente para detectar fiebre u otros síntomas o signos de infección y deben tratarse de inmediato si se presentan dichos síntomas o signos. Los pacientes con neutropenia grave (recuento absoluto de neutrófilos <1000 / mm3) deben suspender FANAPT y hacer que se les siga el WBC hasta la recuperación.
Hiperprolactinemia
Al igual que con otras drogas que antagonizan los receptores de dopamina D2, FANAPT eleva los niveles de prolactina.
La hiperprolactinemia puede suprimir la GnRH hipotalámica, lo que reduce la secreción de gonadotropina hipofisaria. Esto, a su vez, puede inhibir la función reproductiva al alterar la gonadalsteroidogénesis tanto en pacientes femeninos como masculinos. Se ha informado de galactorrea, amenorrea, ginecomastia e impotencia con compuestos que aumentan la prolactina. La hiperprolactinemia de larga duración cuando se asocia con hipogonadismo puede conducir a una disminución de la densidad ósea tanto en pacientes femeninos como masculinos.
Los experimentos de cultivo de tejidos indican que aproximadamente un tercio de los cánceres de mama humanos son in vitro dependientes de prolactina, un factor de importancia potencial si se contempla la prescripción de estos medicamentos en una paciente con seno previamente detectado cáncer. Se observaron cambios proliferativos en la glándula mamaria y aumentos en la prolactina sérica en ratones y ratas tratadas con FANAPT. Ni los estudios clínicos ni los estudios epidemiológicos realizados hasta la fecha han demostrado una asociación entre la administración crónica de esta clase de fármacos y la tumorigénesis en humanos; la evidencia disponible se considera demasiado limitada para ser concluyente en este momento.
En un ensayo a corto plazo controlado con placebo (4 semanas), el cambio medio desde el inicio hasta el punto final en los niveles de prolactina en plasma para el grupo tratado con FANAPT 24 mg / día hubo un aumento de 2.6 ng / mL en comparación con una disminución de 6.3 ng / mL en el grupo placebo. En este ensayo, se observaron niveles elevados de prolactina en plasma en el 26% de los adultos tratados con FANAPT en comparación con el 12% en el grupo placebo. En los ensayos a corto plazo, FANAPT se asoció con niveles modestos de elevación de prolactina en comparación con mayores elevaciones de prolactina observadas con algunos otros agentes antipsicóticos. En el análisis conjunto de estudios clínicos que incluyeron ensayos a más largo plazo, en 3210 adultos tratados con iloperidona, se notificó ginecomastia en 2 sujetos masculinos (0.1%) en comparación con el 0% en pacientes tratados con placebo, y se informó galactorrea en 8 sujetos femeninos (0.2%) en comparación con 3 sujetos femeninos (0.5%) en pacientes tratados con placebo pacientes
Regulación de la temperatura corporal
La interrupción de la capacidad del cuerpo para reducir la temperatura corporal central se ha atribuido a los agentes antipsicóticos. Se recomienda la atención adecuada cuando se prescribe FANAPT para pacientes que experimentarán afecciones que pueden contribuir a una elevación del cuerpo central temperatura, por ejemplo, hacer ejercicio vigoroso, exposición al calor extremo, recibir medicación concomitante con actividad anticolinérgica o estar sujeto a deshidración.
Disfagia
La dismotilidad esofágica y la aspiración se han asociado con el uso de drogas antipsicóticas. La neumonía por aspiración es una causa común de morbilidad y mortalidad en pacientes de edad avanzada. FANAPT y otros medicamentos antipsicóticos deben usarse con precaución en pacientes con riesgo de neumonía por aspiración.
Suicidio
La posibilidad de un intento de suicidio es inherente a la enfermedad psicótica, y una estrecha supervisión de los pacientes de alto riesgo debe acompañar a la terapia con medicamentos. Las recetas de FANAPT deben redactarse para la menor cantidad de tabletas compatibles con el buen manejo del paciente para reducir el riesgo de sobredosis.
Priapismo
Se informaron tres casos de priapismo en el programa de precomercialización FANAPT. Se ha informado que las drogas con efectos de bloqueo alfa-adrenérgico inducen priapismo. FANAPT comparte esta actividad farmacológica. El priapismo severo puede requerir intervención quirúrgica.
Potencial de deterioro cognitivo y motor
FANAPT, como otros antipsicóticos, tiene el potencial de perjudicar el juicio, el pensamiento o las habilidades motoras. En los ensayos a corto plazo controlados con placebo, se informó somnolencia (incluida la sedación) en el 11,9% (104/874) de pacientes adultos tratados con FANAPT a dosis de 10 mg / día o más versus 5.3% (31/587) tratados con placebo. Se debe advertir a los pacientes sobre la operación de maquinaria peligrosa, incluidos los automóviles, hasta que estén razonablemente seguros de que la terapia con FANAPT no los afecta negativamente.
parte superior
Reacciones adversas
Experiencia en estudios clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, se observaron tasas de reacciones adversas en el ensayo clínico de un fármaco. no puede compararse directamente con las tasas en los ensayos clínicos de otro fármaco y puede no reflejar las tasas observadas en la clínica práctica. La información a continuación se deriva de una base de datos de ensayos clínicos para FANAPT que consta de 3229 pacientes expuestos a FANAPT a dosis de 10 mg / día o más, para el tratamiento de la esquizofrenia. De estos, 999 recibieron FANAPT durante al menos 6 meses, con 657 expuestos a FANAPT durante al menos 12 meses. Todos estos pacientes que recibieron FANAPT estaban participando en ensayos clínicos de dosis múltiples. Las condiciones y la duración del tratamiento con FANAPT variaron mucho e incluyeron (en categorías superpuestas), etiqueta abierta y fases de estudios doble ciego, pacientes hospitalizados y ambulatorios, estudios de dosis fija y dosis flexible, y estudios a corto y largo plazo exposición.
La información presentada en estas secciones se derivó de datos agrupados de 4 semanas controladas con placebo, 4 o 6 semanas, estudios de dosis fija o flexible en pacientes que recibieron FANAPT a dosis diarias dentro de un rango de 10 a 24 mg (n = 874).
Reacciones adversas que ocurren con una incidencia del 2% o más entre los pacientes tratados con FANAPT y más frecuentes que el placebo
La Tabla 7 enumera las incidencias agrupadas de reacciones adversas que se informaron espontáneamente en cuatro semanas controladas con placebo, 4 o 6 semanas, estudios de dosis fija o flexible, que enumeran las reacciones que ocurrieron en el 2% o más de los pacientes tratados con FANAPT en cualquiera de las dosis grupos, y para los cuales la incidencia en pacientes tratados con FANAPT en cualquier grupo de dosis fue mayor que la incidencia en pacientes tratados con placebo.

Reacciones adversas relacionadas con la dosis en ensayos clínicos
Según los datos agrupados de 4 estudios controlados con placebo, de 4 o 6 semanas, de dosis fija o flexible, las reacciones adversas que ocurrieron con más del 2% incidencia en los pacientes tratados con FANAPT, y para los cuales la incidencia en pacientes tratados con FANAPT 20-24 mg / día fue dos veces mayor que la incidencia en Los pacientes tratados con FANAPT 10-16 mg / día fueron: molestias abdominales, mareos, hipotensión, rigidez musculoesquelética, taquicardia y peso. aumentado.
Reacciones adversas comunes y relacionadas con fármacos en ensayos clínicos
Según los datos agrupados de 4 estudios de dosis fija o flexible, controlados con placebo, de 4 o 6 semanas, las siguientes reacciones adversas ocurrieron con una incidencia ≥5% en los pacientes tratados con FANAPT y al menos el doble de la dosis de placebo para al menos 1 dosis: mareos, boca seca, fatiga, congestión nasal, somnolencia, taquicardia, hipotensión ortostática y peso aumentado. Los mareos, la taquicardia y el aumento de peso fueron al menos dos veces más comunes con 20-24 mg / día que con 10-16 mg / día.
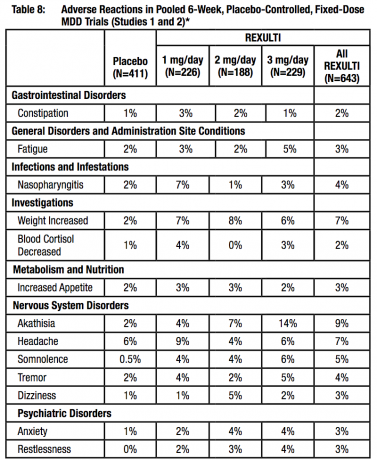
Síntomas extrapiramidales (EPS) en ensayos clínicos
Los datos agrupados de los 4 estudios controlados con placebo, de 4 o 6 semanas, de dosis fija o flexible proporcionaron información sobre EPS. Los datos de eventos adversos recopilados de esos ensayos mostraron las siguientes tasas de eventos adversos relacionados con EPS, como se muestra en la Tabla 8.
Reacciones adversas asociadas con la interrupción del tratamiento en ensayos clínicos
Según los datos agrupados de 4 estudios controlados con placebo, de 4 o 6 semanas, de dosis fija o flexible, no hubo diferencia en la incidencia de interrupción debido a eventos adversos entre tratados con FANAPT (5%) y tratados con placebo (5%) pacientes Los tipos de eventos adversos que llevaron a la interrupción fueron similares para los pacientes tratados con FANAPT y con placebo.
Diferencias demográficas en reacciones adversas en ensayos clínicos
Un examen de subgrupos de población en los 4 controlados con placebo, de 4 o 6 semanas, fijos o los estudios de dosis flexibles no revelaron ninguna evidencia de diferencias en la seguridad en función de la edad, género o raza
Anormalidades de pruebas de laboratorio en ensayos clínicos
No hubo diferencias entre FANAPT y placebo en la incidencia de interrupción debido a cambios en la hematología, análisis de orina o química del suero.
En ensayos controlados con placebo a corto plazo (4 a 6 semanas), hubo 1.0% (13/1342) pacientes tratados con iloperidona con hematocrito al menos una vez por debajo del rango normal extendido durante el tratamiento posterior a la aleatorización, en comparación con 0.3% (2/585) en placebo. El rango normal extendido para el hematocrito reducido se definió en cada uno de estos ensayos como el valor 15% por debajo del rango normal para el laboratorio centralizado que se utilizó en el ensayo.
Otras reacciones durante la evaluación previa a la comercialización de FANAPT
La siguiente es una lista de términos de MedDRA que reflejan reacciones adversas en pacientes tratados con FANAPT en dosis múltiples ≥ 4 mg / día durante cualquier fase de un ensayo con la base de datos de 3210 tratados con FANAPT pacientes Se incluyen todas las reacciones informadas, excepto las que ya figuran en la Tabla 7 u otras partes de las Reacciones adversas (6), las consideradas en el Advertencias y precauciones (5), aquellos términos de reacción que fueron tan generales que no fueron informativos, reacciones informadas en menos de 3 pacientes y que no fueron graves ni potencialmente mortales, reacciones que de otro modo son comunes como reacciones de fondo, y reacciones consideradas improbables como drogas relacionado.
Las reacciones se clasifican adicionalmente según la clasificación de órganos del sistema MedDRA y se enumeran en orden de frecuencia decreciente de acuerdo con lo siguiente definiciones: los eventos adversos frecuentes son aquellos que ocurren en al menos 1/100 pacientes (solo los que no figuran en la Tabla 7 aparecen en este listado); reacciones adversas infrecuentes son aquellas que ocurren en 1/100 a 1/1000 pacientes; Los eventos raros son aquellos que ocurren en menos de 1/1000 pacientes.
Trastornos de la sangre y linfáticos: Poco frecuentes: anemia, anemia por deficiencia de hierro; Raro-leucopenia
Trastornos cardíacos: frecuentes: palpitaciones; Raras: arritmia, bloqueo auriculoventricular de primer grado, insuficiencia cardíaca (incluso congestiva y aguda)
Trastornos del oído y del laberinto: infrecuente: vértigo, tinnitus
Trastornos endocrinos: poco frecuentes: hipotiroidismo
Trastornos oculares: Frecuentes: conjuntivitis (incluso alérgica); Poco frecuentes: ojo seco, blefaritis, edema de párpados, hinchazón de los ojos, opacidades lenticulares, cataratas, hiperemia (incluida la conjuntiva)
Trastornos gastrointestinales: Poco frecuentes: gastritis, hipersecreción salival, incontinencia fecal, ulceración bucal; Raras: estomatitis aftosa, úlcera duodenal, hernia de hiato, hiperclorhidria, ulceración labial, esofagitis por reflujo, estomatitis
Trastornos generales y condiciones del sitio administrativo: Poco frecuentes: edema (general, picaduras, debido a enfermedad cardíaca), dificultad para caminar, sed; Raras - hipertermia
Trastornos hepatobiliares: poco frecuentes - colelitiasis
Investigaciones: Frecuentes: disminución de peso; Poco frecuentes: disminución de la hemoglobina, aumento del recuento de neutrófilos, disminución del hematocrito
Trastornos del metabolismo y de la nutrición: Poco frecuentes: aumento del apetito, deshidratación, hipocalemia, retención de líquidos.
Trastornos musculoesqueléticos y del tejido conectivo: frecuentes: mialgia, espasmos musculares; Raro - tortícolis
Trastornos del sistema nervioso: infrecuente: parestesia, hiperactividad psicomotora, inquietud, amnesia, nistagmo; Raras - síndrome de piernas inquietas
Trastornos psiquiátricos: frecuentes: inquietud, agresión, engaño; Poco frecuentes: hostilidad, disminución de la libido, paranoia, anorgasmia, estado de confusión, manía, catatonia, cambios de humor, pánico ataque, trastorno obsesivo compulsivo, bulimia nerviosa, delirio, polidipsia psicógena, trastorno de control de impulsos, mayor depresión
Trastornos renales y urinarios: frecuentes - incontinencia urinaria; Poco frecuentes: disuria, polaquiuria, enuresis, nefrolitiasis; Raras: retención urinaria, insuficiencia renal aguda
Trastornos del sistema reproductivo y de los senos: Frecuentes: disfunción eréctil; Infrequen: dolor testicular, amenorrea, dolor en los senos; Raras: menstruación irregular, ginecomastia, menorragia, metrorragia, hemorragia posmenopáusica, prostatitis.
Trastornos respiratorios, torácicos y mediastínicos: poco frecuentes: epistaxis, asma, rinorrea, congestión nasal, sequedad nasal; Raras: garganta seca, síndrome de apnea del sueño, disnea de esfuerzo.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de FANAPT: eyaculación retrógrada y reacciones de hipersensibilidad (incluida la anafilaxia; angioedema; opresión en la garganta; hinchazón orofaríngea; hinchazón de la cara, labios, boca y lengua; urticaria; erupción; y prurito). Debido a que estas reacciones se informaron voluntariamente de una población de tamaño incierto, no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al medicamento.
parte superior
Interacciones con la drogas
Dados los efectos primarios del SNC de FANAPT, se debe tener precaución cuando se toma en combinación con otras drogas de acción central y alcohol. Debido a su antagonismo del receptor alfa1-adrenérgico, FANAPT tiene el potencial de mejorar el efecto de ciertos agentes antihipertensivos.
Posibilidad de que otras drogas afecten a FANAPT
La iloperidona no es un sustrato para las enzimas CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 o CYP2E1. Esto sugiere que es poco probable una interacción de iloperidona con inhibidores o inductores de estas enzimas u otros factores, como fumar. Tanto CYP3A4 como CYP2D6 son responsables del metabolismo de la iloperidona. Los inhibidores de CYP3A4 (p. Ej., Ketoconazol) o CYP2D6 (p. Ej., Fluoxetina, paroxetina) pueden inhibir la eliminación de iloperidona y aumentar los niveles sanguíneos.
Ketoconazol: administración conjunta de ketoconazol (200 mg dos veces al día durante 4 días), un potente inhibidor de CYP3A4, con una dosis única de 3 mg de iloperidona a 19 Voluntarios sanos, entre 18 y 45 años, aumentaron el área bajo la curva (AUC) de iloperidona y sus metabolitos P88 y P95 en un 57%, 55% y 35%. respectivamente. Las dosis de iloperidona deben reducirse aproximadamente a la mitad cuando se administran con ketoconazol u otros inhibidores potentes del CYP3A4 (p. Ej., Itraconazol). No se han estudiado los inhibidores más débiles (p. Ej., Eritromicina, jugo de toronja). Cuando el inhibidor de CYP3A4 se retira de la terapia de combinación, la dosis de iloperidona debe volver al nivel anterior.
Fluoxetina: administración conjunta de fluoxetina (20 mg dos veces al día durante 21 días), un potente inhibidor de CYP2D6, con una dosis única de 3 mg de iloperidona a 23 voluntarios sanos, de 29 a 44 años, quienes fueron clasificados como metabolizadores extensivos del CYP2D6, aumentaron el AUC de iloperidona y su metabolito P88, de 2 a 3 veces, y disminuyeron el AUC de su metabolito P95 en una mitad. Las dosis de iloperidona deben reducirse a la mitad cuando se administran con fluoxetina. Cuando se retira fluoxetina de la terapia de combinación, la dosis de iloperidona debe volver al nivel anterior. Se esperaría que otros inhibidores potentes de CYP2D6 tengan efectos similares y necesiten reducciones de dosis apropiadas. Cuando el inhibidor de CYP2D6 se retira de la terapia de combinación, la dosis de iloperidona se puede aumentar al nivel anterior.
Paroxetina: administración conjunta de paroxetina (20 mg / día durante 5-8 días), un potente inhibidor de CYP2D6, con múltiples dosis de iloperidona (8 o 12 mg dos veces al día) a pacientes con esquizofrenia de edades comprendidas entre 18 y 65 años resultó en un aumento de las concentraciones máximas medias de estado estacionario iloperidona y su metabolito P88, aproximadamente 1,6 veces, y disminuyeron las concentraciones máximas medias en estado estacionario de su metabolito P95 en una mitad. Las dosis de iloperidona deben reducirse a la mitad cuando se administran con paroxetina. Cuando la paroxetina se retira de la terapia de combinación, la dosis de iloperidona debe volver al nivel anterior. Se esperaría que otros inhibidores potentes de CYP2D6 tengan efectos similares y necesiten reducciones de dosis apropiadas. Cuando el inhibidor de CYP2D6 se retira de la terapia de combinación, la dosis de iloperidona se puede aumentar a niveles anteriores.
Paroxetina y ketoconazol: administración conjunta de paroxetina (20 mg una vez al día durante 10 días), un inhibidor de CYP2D6 y ketoconazol (200 mg dos veces al día) con dosis múltiples de iloperidona (8 o 12 mg dos veces al día) a pacientes con esquizofrenia de 18 a 65 años de edad resultó en un 1,4 aumento de la concentración de iloperidona y su metabolito P88 en estado estacionario y una disminución de 1.4 veces en la P95 en presencia de paroxetina Por lo tanto, administrar iloperidona con inhibidores de sus dos vías metabólicas no contribuyó al efecto de ninguno de los inhibidores administrados solos. Por lo tanto, las dosis de iloperidona deben reducirse aproximadamente a la mitad si se administran concomitantemente con un inhibidor de CYP2D6 y CYP3A4.
Posibilidad de que FANAPT afecte a otras drogas
Los estudios in vitro en microsomas hepáticos humanos mostraron que la iloperidona no inhibe sustancialmente el metabolismo de medicamentos metabolizados por las siguientes isoenzimas del citocromo P450: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 o CYP2E1. Además, los estudios in vitro en microsomas hepáticos humanos mostraron que la iloperidona no tiene enzimas inductoras. propiedades, específicamente para las siguientes isoenzimas del citocromo P450: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 y CYP3A5.
Dextrometorfano: un estudio en voluntarios sanos mostró que los cambios en la farmacocinética del dextrometorfano (dosis de 80 mg) cuando se administra una dosis de 3 mg de La administración conjunta de iloperidona dio como resultado un aumento del 17% en la exposición total y un aumento del 26% en las concentraciones plasmáticas máximas C max de dextrometorfano Por lo tanto, es poco probable una interacción entre iloperidona y otros sustratos de CYP2D6.
Fluoxetina: una dosis única de 3 mg de iloperidona no tuvo efecto sobre la farmacocinética de fluoxetina (20 mg dos veces al día).
Midazolam (un sustrato sensible de CYP 3A4): un estudio en pacientes con esquizofrenia mostró un aumento de menos del 50% en el total de midazolam exposición al estado estacionario de iloperidona (14 días de dosificación oral con hasta 10 mg de iloperidona dos veces al día) y sin efecto sobre el midazolam C max. Por lo tanto, es poco probable una interacción entre iloperidona y otros sustratos de CYP3A4.
Los medicamentos que prolongan el intervalo QT FANAPT no deben usarse con ningún otro medicamento que prolongue el intervalo QT.
parte superior
Uso en poblaciones específicas
Registro de exposición al embarazo
Existe un registro de exposición al embarazo que monitorea los resultados del embarazo en mujeres expuestas a FANAPT durante el embarazo. Para obtener más información, comuníquese con el Registro Nacional de Embarazo para Antipsicóticos Atípicos al 1-866-961-2388 o visite http://womensmentalhealth.org/clinical-and -investigación-programas / embarazoregisterio /.
Resumen de riesgos
Los recién nacidos cuyas madres están expuestas a medicamentos antipsicóticos, incluido FANAPT, durante el tercer trimestre del embarazo corren el riesgo de presentar síntomas extrapiramidales o de abstinencia después del parto. Los limitados datos disponibles con FANAPT en mujeres embarazadas no son suficientes para informar el riesgo asociado a los medicamentos de defectos congénitos mayores y abortos espontáneos. La iloperidona no fue teratogénica cuando se administró por vía oral a ratas preñadas durante la organogénesis a dosis de hasta 26 veces la dosis humana máxima recomendada de 24 mg / día en mg / m2. Sin embargo, prolongó la duración del embarazo y el parto, aumentó los nacimientos muertos, las muertes intrauterinas tempranas, aumentó la incidencia de retrasos en el desarrollo y disminuyó la supervivencia de las crías posparto. La iloperidona no fue teratogénica cuando se administró por vía oral a conejos preñadas durante la organogénesis a dosis de hasta 20 veces la MRHD en mg / m2. Sin embargo, aumentó las muertes intrauterinas tempranas y disminuyó la viabilidad fetal a término a la dosis más alta, que también fue una dosis tóxica para la madre.
Se desconoce el riesgo de fondo de defectos congénitos importantes y aborto involuntario para la población indicada. En la población general de EE. UU., El riesgo de fondo estimado de defectos congénitos importantes y aborto involuntario en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente.
Consideraciones clínicas
Reacciones adversas fetales / neonatales
Síntomas extrapiramidales y / o de abstinencia, que incluyen agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria y Se han informado trastornos alimentarios en recién nacidos cuyas madres estuvieron expuestas a medicamentos antipsicóticos durante el tercer trimestre de el embarazo. Estos síntomas han variado en severidad. Algunos neonatos se recuperaron en horas o días sin tratamiento específico; otros requirieron hospitalización prolongada. Monitoree a los recién nacidos en busca de síntomas extrapiramidales y / o de abstinencia y maneje los síntomas adecuadamente.
Datos
Datos de animales
En un estudio de desarrollo embriofetal, a las ratas preñadas se les administró 4, 16 o 64 mg / kg / día (1.6, 6.5 y 26 veces el dosis humana máxima recomendada (MRHD) de 24 mg / día en una base de mg / m2) de iloperidona por vía oral durante el período de organogénesis La dosis más alta causó un aumento de las muertes intrauterinas tempranas, disminución del peso y la longitud del feto, disminución de la osificación esquelética fetal, y una mayor incidencia de anomalías esqueléticas fetales menores y variaciones; Esta dosis también causó una disminución en el consumo de alimentos maternos y el aumento de peso.
En un estudio de desarrollo embriofetal, a las conejas preñadas se les administró 4, 10 o 25 mg / kg / día (3, 8 y 20 veces la MRHD en una base de mg / m2) de iloperidona durante el período de organogénesis. La dosis más alta causó un aumento de las muertes intrauterinas tempranas y una disminución de la viabilidad fetal a término; Esta dosis también causó toxicidad materna.
En estudios adicionales en los que a las ratas se les administró iloperidona a dosis similares a las anteriores, ya sea desde la preconcepción o desde día 17 de gestación y continuando hasta el destete, los efectos reproductivos adversos incluyeron embarazo prolongado y parto, aumento tasas de mortalidad fetal, aumento de la incidencia de variaciones viscerales fetales, disminución de los pesos fetales y de las crías, y disminución de la cría posparto supervivencia. No hubo efectos farmacológicos en el desarrollo neuroconductual o reproductivo de los cachorros sobrevivientes. Las dosis sin efecto oscilaron entre 4 y 12 mg / kg, excepto por el aumento en las tasas de muerte fetal que se produjo con la dosis más baja probada de 4 mg / kg, que es 1.6 veces el MRHD en una base de mg / m2. Se observó toxicidad materna a las dosis más altas en estos estudios.
El metabolito de iloperidona P95, que es un importante metabolito circulante de iloperidona en humanos pero no está presente en Se administraron cantidades significativas en ratas a ratas preñadas durante el período de organogénesis a dosis orales de 20, 80 o 200 mg. kg / día No se observaron efectos teratogénicos. La osificación esquelética tardía ocurrió en todas las dosis. No se produjo toxicidad materna significativa. Los niveles plasmáticos de P95 (AUC) a la dosis más alta probada fueron 2 veces mayores que en los humanos que recibieron la MRHD de iloperidona.
Lactancia
Resumen de riesgos
No hay información sobre la presencia de iloperidona o sus metabolitos en la leche humana, el efectos de la iloperidona en un niño amamantado, ni los efectos de la iloperidona en la leche humana producción. Iloperidona está presente en la leche de rata. Debido a la posibilidad de reacciones adversas graves en lactantes amamantados, aconseje a una mujer que no amamante durante el tratamiento con FANAPT.
Datos La transferencia de radiactividad a la leche de ratas lactantes se investigó después de una dosis única de [14C] iloperidona a 5 mg / kg. La concentración de radiactividad en la leche a las 4 horas después de la dosis fue casi 10 veces mayor que en plasma al mismo tiempo. Sin embargo, a las 24 horas después de la dosificación, las concentraciones de radiactividad en la leche habían caído a valores ligeramente más bajos que el plasma. El perfil metabólico en la leche fue cualitativamente similar al del plasma.
Uso pediátrico No se ha establecido la seguridad y efectividad en pacientes pediátricos y adolescentes.
Uso geriátrico
Los estudios clínicos de FANAPT en el tratamiento de la esquizofrenia no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden o no de manera diferente a los adultos más jóvenes pacientes De los 3210 pacientes tratados con FANAPT en ensayos previos a la comercialización, 25 (0,5%) tenían ≥65 años y no había pacientes ≥75 años.
Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con FANAPT tienen un mayor riesgo de muerte en comparación con el placebo. FANAPT no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia.
Insuficiencia renal
Debido a que FANAPT es altamente metabolizado, con menos del 1% del fármaco excretado sin cambios, es poco probable que la insuficiencia renal sola tenga un impacto significativo en la farmacocinética de FANAPT. La insuficiencia renal (aclaramiento de creatinina <30 ml / min) tuvo un efecto mínimo sobre la Cmáx de iloperidona (administrada en una dosis única de 3 mg) y sus metabolitos P88 y P95 en cualquiera de los 3analitos medidos. AUC0– ∞ aumentó en un 24%, disminuyó en un 6% y aumentó en un 52% para iloperidona, P88 y P95, respectivamente, en sujetos con insuficiencia renal.
Deterioro hepático
No es necesario ajustar la dosis de FANAPT en pacientes con insuficiencia hepática leve. Los pacientes con insuficiencia hepática moderada pueden requerir una reducción de la dosis. FANAPT no se recomienda para pacientes con insuficiencia hepática grave.
En sujetos adultos con insuficiencia hepática leve no se observaron diferencias relevantes en la farmacocinética de iloperidona, P88 o P95 (total o no unido) en comparación con los controles de adultos sanos. En sujetos con insuficiencia hepática moderada, una exposición libre más alta (2 veces) y más variable a los metabolitos activos fue P88. observado en comparación con controles sanos, mientras que la exposición a iloperidona y P95 fue generalmente similar (menos del 50% de cambio en comparación con controlar). Dado que no se ha realizado un estudio en sujetos con insuficiencia hepática grave, FANAPT no se recomienda para pacientes con insuficiencia hepática grave.
Estado de fumar
Basado en estudios in vitro que utilizan enzimas hepáticas humanas, FANAPT no es un sustrato para CYP1A2; fumar, por lo tanto, no debería tener un efecto sobre la farmacocinética de FANAPT.
El embarazo
parte superior
Abuso y dependencia de drogas
Sustancia controlada
FANAPT no es una sustancia controlada.
Abuso
FANAPT no se ha estudiado sistemáticamente en animales o humanos por su potencial de abuso, tolerancia o dependencia física. Si bien los ensayos clínicos no revelaron ninguna tendencia al comportamiento de búsqueda de drogas, estas observaciones no fueron sistemáticas y no es posible para predecir sobre la base de esta experiencia el grado en que una droga activa del SNC, FANAPT, será mal utilizada, desviada y / o abusada una vez comercializado En consecuencia, los pacientes deben ser evaluados cuidadosamente por un historial de abuso de drogas, y dichos pacientes deben ser evaluados observado de cerca para detectar signos de mal uso o abuso de FANAPT (por ejemplo, desarrollo de tolerancia, aumento de dosis, búsqueda de drogas comportamiento).
parte superior
Sobredosis
Experiencia humana
En los ensayos previos a la comercialización que involucraron a más de 3210 pacientes, la sobredosis accidental o intencional de FANAPT fue documentado en 8 pacientes que van desde 48 mg a 576 mg tomados a la vez y 292 mg tomados durante 3 días período. No se informaron muertes de estos casos. La mayor ingestión única confirmada de FANAPT fue de 576 mg; No se observaron efectos físicos adversos para este paciente. La siguiente ingestión confirmada más grande de FANAPT fue de 438 mg durante un período de 4 días; Se informaron síntomas extrapiramidales y un intervalo QTc de 507 ms para este paciente sin secuelas cardíacas. Este paciente reanudó el tratamiento con FANAPT durante 11 meses adicionales.
En general, los signos y síntomas informados fueron los que resultaron de una exageración de los efectos farmacológicos conocidos (por ejemplo, somnolencia y sedación, taquicardia e hipotensión) de FANAPT.
Manejo de sobredosis
No existe un antídoto específico para FANAPT. Por lo tanto, se deben instituir medidas de apoyo apropiadas. En caso de sobredosis aguda, el médico debe establecer y mantener una vía aérea y garantizar una oxigenación y ventilación adecuadas. Se debe considerar el lavado gástrico (después de la intubación, si el paciente está inconsciente) y la administración de carbón activado junto con un laxante. La posibilidad de embotamiento, convulsiones o reacción distónica de la cabeza y el cuello después de una sobredosis puede crear un riesgo de aspiración con emesis inducida. La monitorización cardiovascular debe comenzar de inmediato y debe incluir una monitorización continua de ECG para detectar posibles arritmias. Si se administra la terapia antiarrítmica, no se deben usar disopiramida, procainamida y quinidina, ya que tienen el potencial de prolongar el QT y podrían ser aditivos a los de FANAPT. Del mismo modo, es razonable esperar que las propiedades de bloqueo alfa del bretilio puedan ser aditivas a las de FANAPT, dando como resultado una hipotensión problemática. La hipotensión y el colapso circulatorio deben tratarse con medidas apropiadas, como líquidos intravenosos o agentes simpaticomiméticos. (la epinefrina y la dopamina no deben usarse, ya que la estimulación beta puede empeorar la hipotensión en el contexto de alfa inducido por FANAPT bloqueo). En casos de síntomas extrapiramidales severos, se debe administrar medicación anticolinérgica. La supervisión médica cercana debe continuar hasta que el paciente se recupere.
parte superior
Descripción
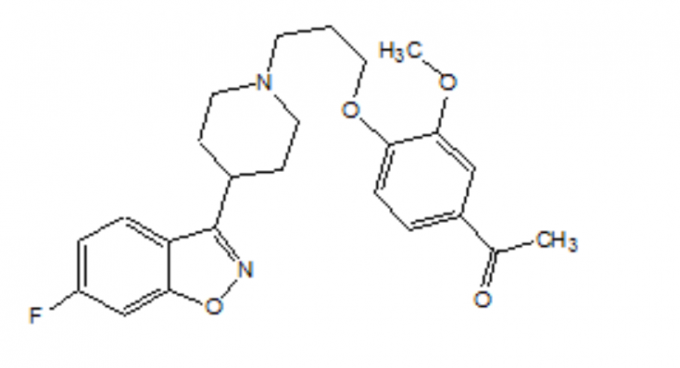
FANAPT es un antipsicótico atípico que pertenece a la clase química de derivados de piperidinil-benzisoxazol. Su nombre químico es 4 '- [3- [4- (6-fluoro-1,2-benzisoxazol-3-il) piperidino] propoxi] -3'-metoxiacetofenona. Su fórmula molecular es C24H27FN2O4 y su peso molecular es 426.48. La fórmula estructural es:
La iloperidona es un polvo finamente cristalino de color blanco a blanquecino. Es prácticamente insoluble en agua, muy poco soluble en HCl 0.1 N y libremente soluble en cloroformo, etanol, metanol y acetonitrilo.
Los comprimidos de FANAPT están destinados únicamente a la administración oral. Cada ronda, sin recubrimiento
la tableta contiene 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg o 12 mg de iloperidona. Los ingredientes inactivos son: lactosa monohidrato, celulosa microcristalina, hidroxipropilmetilcelulosa, crospovidona, estearato de magnesio, silicio coloidal.
dióxido y agua purificada (eliminada durante el procesamiento). Las tabletas son blancas, redondas, planas, con bordes biselados e identificadas con el logotipo "" grabado en un lado y la resistencia de la tableta "1", "2", "4", "6", "8", "10", o "12" grabado en el otro lado.
parte superior
Farmacología Clínica
Mecanismo de acción
Se desconoce el mecanismo de acción de la iloperidona en la esquizofrenia. Sin embargo, la eficacia de la iloperidona podría estar mediada por una combinación de antagonismo de dopamina tipo 2 (D2) y serotonina tipo 2 (5-HT2).
Iloperidona forma un metabolito activo, P88, que tiene un perfil de unión al receptor in vitro similar al fármaco original.
Farmacodinámica
Iloperidona actúa como un antagonista con alta afinidad (nM) de unión a la serotonina 5-HT2A dopamina D2 y Receptores D3 y receptores de norepinefrina NEα1 (valores de Ki de 5.6, 6.3, 7.1 y 0.36 nM, respectivamente). La iloperidona tiene una afinidad moderada por los receptores de dopamina D4 y serotonina 5-HT6 y 5 -HT7 (valores de Ki de 25, 43 y 22, nM respectivamente), y baja afinidad por los receptores de serotonina 5-HT1A, dopamina D1 e histamina H1 (valores de Ki de 168, 216 y 437 nM, respectivamente). La iloperidona no tiene una afinidad apreciable (Ki> 1000 nM) por los receptores muscarínicos colinérgicos. La afinidad del metabolito de iloperidona P88 es generalmente igual o menor que la del compuesto original, mientras que el metabolito P95 solo muestra afinidad por 5-HT2A (valor de Ki de 3.91) y los receptores NEα1A, NEα1B, NEα1D y NEα2C (valores de Ki de 4.7, 2.7, 8.8 y 4.7 nM respectivamente).
Farmacocinética
La vida media de eliminación observada para iloperidona, P88 y P95 en metabolizadores extensivos CYP2D6 (EM) son 18, 26 y 23 horas, respectivamente, y en metabolizadores lentos (PM) son 33, 37 y 31 horas, respectivamente. Las concentraciones en estado estacionario se alcanzan dentro de los 3 a 4 días posteriores a la administración. La acumulación de iloperidona es predecible a partir de la farmacocinética de dosis única. La farmacocinética de iloperidona es más que proporcional a la dosis. La eliminación de iloperidona es principalmente a través del metabolismo hepático que involucra 2 isoenzimas P450, CYP2D6 y CYP3A4.
Absorción: Iloperidona se absorbe bien después de la administración de la tableta con concentraciones plasmáticas máximas que ocurren dentro de 2 a 4 horas; mientras que la biodisponibilidad relativa de la formulación del comprimido en comparación con la solución oral es del 96%. La administración de iloperidona con una comida estándar alta en grasas no afectó significativamente la Cmax o el AUC de iloperidona, P88 o P95, pero retrasó la Tmax en 1 hora para iloperidona, 2 horas para P88 y 6 horas para P95. FANAPT puede administrarse sin tener en cuenta las comidas.
Distribución: Iloperidona tiene un aclaramiento aparente (aclaramiento / biodisponibilidad) de 47 a 102 L / h, con un volumen aparente de distribución de 1340-2800 L. A concentraciones terapéuticas, la fracción libre de iloperidona en plasma es ~ 3% y de cada metabolito (P88 y P95) es ~ 8%.
Metabolismo y eliminación: Iloperidona se metaboliza principalmente por 3 vías de biotransformación: reducción de carbonilo, hidroxilación (mediada por CYP2D6) y desmetilación de O (mediada por CYP3A4). Hay 2 metabolitos de iloperidona predominantes, P95 y P88. El metabolito de iloperidona P95 representa el 47.9% del AUC de iloperidona y sus metabolitos en plasma en estado estacionario para metabolizadores extensivos (EM) y el 25% para metabolizadores pobres (PM). El metabolito activo P88 representa el 19.5% y el 34.0% de la exposición total al plasma en EM y PM, respectivamente.
Aproximadamente el 7% -10% de los caucásicos y el 3% -8% de los negros / afroamericanos carecen de la capacidad de metabolizar CYP2D6 sustratos y se clasifican como metabolizadores lentos (PM), mientras que el resto son intermedios, extensivos o ultrarrápidos metabolizadores La administración conjunta de FANAPT con inhibidores potentes conocidos de CYP2D6 como la fluoxetina da como resultado un aumento de 2,3 veces aumento de la exposición plasmática a iloperidona y, por lo tanto, la mitad de la dosis de FANAPT debe ser administrado.
Del mismo modo, las PM del CYP2D6 tienen una mayor exposición a la iloperidona en comparación con los EM y las PM deberían reducir su dosis a la mitad. Las pruebas de laboratorio están disponibles para identificar las PM del CYP2D6.
La mayor parte de los materiales radiactivos se recuperaron en la orina (promedio de 58.2% y 45.1% en EM y PM, respectivamente), con las heces representando 19.9% (EM) a 22.1% (PM) de la radiactividad dosificada.
Interacción con el transportador: Iloperidona y P88 no son sustratos de P-gp y la iloperidona es un inhibidor débil de P-gp.
parte superior
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis: se realizaron estudios de carcinogenicidad de por vida en ratones CD-1 y ratas Sprague Dawley. Iloperidona se administró por vía oral a dosis de 2.5, 5.0 y 10 mg / kg / día a ratones CD-1 y 4, 8 y 16 mg / kg / día a Ratas Sprague Dawley (0.5, 1.0 y 2.0 veces y 1.6, 3.2 y 6.5 veces, respectivamente, la MRHD de 24 mg / día en un mg / m2 base). Hubo una mayor incidencia de tumores malignos de la glándula mamaria en ratones hembra tratados con la dosis más baja (2.5 mg / kg / día) solamente. No hubo aumentos relacionados con el tratamiento en la neoplasia en ratas.
El potencial carcinogénico del metabolito de iloperidona P95, que es un importante metabolito circulante de iloperidona en humanos pero no está presente en cantidades significativas en ratones o ratas, se evaluó en un estudio de carcinogenicidad de por vida en ratas Wistar a dosis orales de 25, 75 y 200 mg / kg / día en machos y 50, 150 y 250 (reducido de 400) mg / kg / día en hembras Se produjeron cambios neoplásicos relacionados con el fármaco en varones, en la glándula pituitaria (adenoma de pars distal) en todas las dosis y en el páncreas (adenoma de células de los islotes) con la dosis alta. Los niveles plasmáticos de P95 (AUC) en varones a las dosis probadas (25, 75 y 200 mg / kg / día) fueron aproximadamente 0.4, 3 y 23 veces, respectivamente, la exposición humana a P95 en la MRHD de iloperidona.
Mutagénesis: Iloperidona fue negativa en la prueba de Ames y en las pruebas de micronúcleo de hígado de rata y médula ósea de ratón in vivo. Iloperidona indujo aberraciones cromosómicas en células de ovario de hámster chino (CHO) in vitro a concentraciones que también causaron cierta citotoxicidad.
El metabolito de iloperidona P95 fue negativo en la prueba de Ames, la prueba de aberración cromosómica V79 y una prueba de micronúcleo de médula ósea de ratón in vivo.
Deterioro de la fertilidad: Iloperidona disminuyó la fertilidad a 12 y 36 mg / kg en un estudio en el que se trataron ratas macho y hembra. La dosis sin efecto fue de 4 mg / kg, que es 1.6 veces la MRHD de 24 mg / día en mg / m2.
parte superior
Estudios clínicos
La eficacia de FANAPT en el tratamiento de la esquizofrenia fue respaldada por 2 placebo y ensayos controlados activos a corto plazo (4 y 6 semanas) y uno aleatorizado controlado con placebo a largo plazo prueba de retiro. Todos los ensayos incluyeron pacientes que cumplían con los criterios del DSM-III / IV para la esquizofrenia.
Se utilizaron tres instrumentos para evaluar los signos y síntomas psiquiátricos en estos estudios. La Escala de Síndrome Positivo y Negativo (PANSS) y la Escala de Valoración Psiquiátrica Breve (BPRS) son inventarios de varios ítems.
de psicopatología general generalmente utilizada para evaluar los efectos del tratamiento farmacológico en la esquizofrenia. La evaluación de Impresión clínica global (CGI) refleja la impresión de un observador experto, completamente familiarizado con las manifestaciones de la esquizofrenia, sobre el estado clínico general del paciente.
Un ensayo de 6 semanas, controlado con placebo (n = 706) incluyó 2 rangos de dosis flexibles de FANAPT (12-16 mg / día o 20-24 mg / día) en comparación con placebo y un control activo (risperidona). Para el grupo de 12-16 mg / día, el programa de valoración de FANAPT fue de 1 mg dos veces al día los días 1 y 2, 2 mg dos veces al día los días 3 y 4, 4 mg dos veces al día los días 5 y 6 y 6 mg dos veces al día. diariamente el día 7. Para el grupo de 20-24 mg / día, el programa de valoración de FANAPT fue de 1 mg dos veces al día el día 1, 2 mg dos veces al día el día 2, 4 mg dos veces al día el día 3, 6 mg dos veces al día los días 4 y 5, 8 mg dos veces al día el día 6 y 10 mg dos veces al día el día 7. El punto final primario fue el cambio desde el inicio en la puntuación total de BPRS al final del tratamiento (Día 42). Los rangos de dosis de 12-16 mg / día y 20-24 mg / día de FANAPT fueron superiores al placebo en la puntuación total de BPRS. El fármaco antipsicótico de control activo pareció ser superior a FANAPT en este ensayo dentro de los primeros 2 semanas, un hallazgo que puede explicarse en parte por la titulación más rápida que fue posible para ese fármaco. En los pacientes de este estudio que permanecieron en tratamiento durante al menos 2 semanas, la iloperidona parecía haber tenido una eficacia comparable al control activo.
Un ensayo de 4 semanas, controlado con placebo (n = 604) incluyó una dosis fija de FANAPT (24 mg / día) en comparación con placebo y un control activo (ziprasidona). El calendario de valoración para este estudio fue similar al del estudio de 6 semanas. Este estudio incluyó la titulación de FANAPT comenzando con 1 mg dos veces al día el día 1 y aumentando a 2, 4, 6, 8, 10 y 12 mg dos veces al día los días 2, 3, 4, 5, 6 y 7. El punto final primario fue el cambio desde el inicio en la puntuación total de PANSS al final del tratamiento (Día 28). La dosis de FANAPT de 24 mg / día fue superior al placebo en la puntuación total de PANSS. FANAPT parecía tener una eficacia similar al fármaco de control activo que también necesitaba una titulación lenta de la dosis objetivo.
En un ensayo a largo plazo, pacientes ambulatorios adultos clínicamente estables (n = 303) que cumplen con los criterios del DSM-IV para la esquizofrenia que permanecieron estables después de 12 semanas de el tratamiento abierto con dosis flexibles de FANAPT (8 mg / día - 24 mg / día administrados como dosis dos veces al día) se asignaron al azar a placebo o continuaron con su dosis actual de FANAPT (8 mg / día– 24 mg / día administrados como dosis dos veces al día) para la observación de una posible recaída durante la recaída doble ciego fase de prevención. La estabilización durante la fase abierta se definió como una dosis establecida de FANAPT que no se modificó debido a la eficacia en las 4 semanas previas a la aleatorización, con un puntaje de gravedad CGI de ≤4 y un puntaje total de PANSS ≤70, un puntaje de ≤4 en cada uno de los siguientes ítems individuales de PANSS (delirios P1, desorganización conceptual P2, Comportamiento alucinatorio P3, sospecha / persecución P6, hostilidad P7 o falta de cooperación G8), y no hospitalización o aumento en el nivel de atención para tratar exacerbaciones La recaída o la recaída inminente durante la fase de prevención de recaídas doble ciego se definió como cualquiera de las siguiente: hospitalización debido al empeoramiento de la esquizofrenia, aumento (empeoramiento) de la puntuación total de PANSS ≥30%, CGI-
Puntaje de mejora ≥ 6, el paciente tuvo un comportamiento suicida, homicida o agresivo, o la necesidad de cualquier otro medicamento antipsicótico.

Según el análisis intermedio, un comité de monitoreo de datos independiente decidió que el estudio debería suspenderse temprano debido a la evidencia de eficacia. Según los resultados del análisis intermedio, que fueron confirmados por el conjunto de datos del análisis final, los pacientes tratados con FANAPT experimentó un tiempo estadísticamente significativo más largo para la recaída o la recaída inminente que los pacientes que recibieron placebo. La Figura 1 muestra la proporción acumulada estimada de pacientes con recaída o recaída inminente según el conjunto de datos final.
parte superior
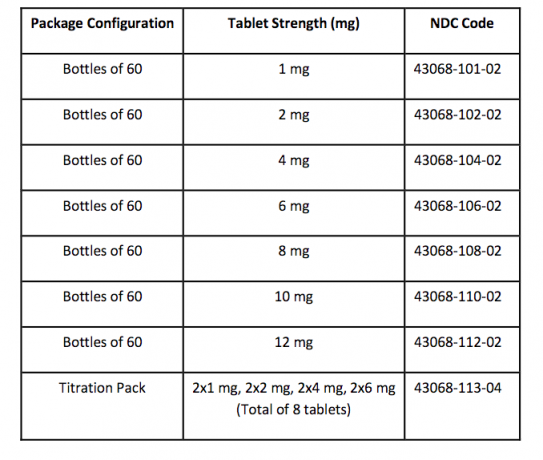
Cómo se suministra / Almacenamiento y manipulación
Las tabletas FANAPT son blancas, redondas e identificadas con un logotipo grabado en un lado y la fuerza de la tableta "1", "2", "4", "6", "8", "10" o "12" en el otro lado. Las tabletas se suministran en las siguientes fortalezas y configuraciones de paquete:
Almacenamiento
Guarde las tabletas FANAPT a temperatura ambiente controlada, 25 ° C (77 ° F); excursiones permitidas a 15 ° a 30 ° C (59 ° a 86 ° F) [Ver temperatura ambiente controlada de la USP]. Proteja las tabletas FANAPT de la exposición a la luz y la humedad.
INFORMACIÓN DE ASESORAMIENTO PARA PACIENTES
Se aconseja a los médicos que discutan los siguientes problemas con los pacientes para quienes recetan FANAPT:
Prolongación del intervalo QT
Se debe aconsejar a los pacientes que consulten a su médico de inmediato si se sienten débiles, pierden el conocimiento o tienen palpitaciones del corazón. Se debe aconsejar a los pacientes que no tomen FANAPT con otros medicamentos que causen la prolongación del intervalo QT. Se debe decir a los pacientes que informen a los médicos que están tomando FANAPT antes de tomar cualquier medicamento nuevo.
Síndrome neuroléptico maligno
Se debe advertir a los pacientes y cuidadores que a veces se deriva un complejo de síntomas potencialmente fatal hasta como NMS se ha informado en asociación con la administración de fármacos antipsicóticos, incluido FANAPT. Los signos y síntomas del SNM incluyen hiperpirexia, rigidez muscular, estado mental alterado y evidencia de autonomía.
inestabilidad (pulso irregular o presión arterial, taquicardia, diaforesis y disritmia cardíaca).
Cambios metabólicos
Los pacientes deben conocer los síntomas de hiperglucemia (azúcar alta en sangre) y diabetes mellitus. Pacientes diagnosticados con diabetes, aquellos con factores de riesgo de diabetes o aquellos que desarrollan estos Los síntomas durante el tratamiento deben controlar su glucosa en sangre al comienzo y periódicamente durante tratamiento. Se debe advertir a los pacientes que se ha producido un aumento de peso durante el tratamiento con FANAPT. Se recomienda la monitorización clínica del peso.
Hipotensión ortostática
Se debe informar a los pacientes sobre el riesgo de hipotensión ortostática, particularmente al momento de iniciar el tratamiento, reiniciar el tratamiento o aumentar la dosis.
Interferencia con el rendimiento cognitivo y motor
Debido a que FANAPT puede tener el potencial de perjudicar el juicio, el pensamiento o las habilidades motoras, se debe advertir a los pacientes sobre operar maquinaria peligrosa, incluidos automóviles, hasta que estén razonablemente seguros de que la terapia FANAPT no los afecta negativamente.
El embarazo
Informe a los pacientes que el uso de Fanapt en el tercer trimestre puede causar síntomas extrapiramidales y / o de abstinencia en un recién nacido. Aconseje a las pacientes que notifiquen a su proveedor de atención médica con un embarazo conocido o sospechado.
Registro de embarazo
Informe a las pacientes que existe un registro de exposición al embarazo que monitorea los resultados del embarazo en mujeres expuestas a FANAPT durante el embarazo
Lactancia
Aconseje a las mujeres que no amamanten durante el tratamiento con FANAPT.
Medicación concomitante
Se debe aconsejar a los pacientes que informen a sus médicos si están tomando, o planean tomar, medicamentos recetados o de venta libre, ya que existe la posibilidad de interacciones.
Alcohol
Se debe aconsejar a los pacientes que eviten el alcohol mientras toman FANAPT.
Exposición al calor y deshidratación
Se debe informar a los pacientes sobre la atención adecuada para evitar el sobrecalentamiento y la deshidratación.
DISTRIBUIDO por:
Vanda Pharmaceuticals Inc.
Washington, DC 20037 EE. UU.
Vanda y Fanapt® son marcas registradas de Vanda Pharmaceuticals Inc. en los Estados Unidos y otros países.
volver arriba
Guía de prescripción de Fanapt (Iloperidona) (PDF)
La información en esta monografía no pretende cubrir todos los usos, instrucciones, precauciones, interacciones de drogas o efectos adversos posibles. Esta información es generalizada y no pretende ser un consejo médico específico. Si tiene preguntas sobre los medicamentos que está tomando o desea obtener más información, consulte con su médico, farmacéutico o enfermero.
última actualización 13/07
de regreso: Página de inicio de farmacología de medicamentos psiquiátricos

