Starlix para el tratamiento de la diabetes
Nombre de la marca: Starlix
Nombre generico: tabletas de nateglinida
Contenido:
Descripción
Farmacología Clínica
Estudios clínicos
Indicaciones y uso
Contraindicaciones
Precauciones
Reacciones adversas
Sobredosis
Dosificación y administración
Cómo suministrado
Starlix, nateglinida, información completa del paciente (en inglés simple)
Descripción
Starlix® (nateglinida) es un agente antidiabético oral utilizado en el tratamiento de la diabetes mellitus tipo 2 [también conocida como diabetes mellitus no dependiente de insulina (NIDDM) o diabetes de inicio en adultos]. Starlix, (-) - N - [(trans-4-isopropilciclohexano) carbonil] -D-fenilalanina, no tiene relación estructural con los secretagogos de insulina de sulfonilurea oral.
La fórmula estructural es como se muestra
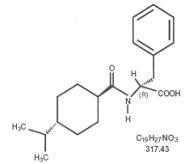
La nateglinida es un polvo blanco con un peso molecular de 317.43. Es libremente soluble en metanol, etanol y cloroformo, soluble en éter, poco soluble en acetonitrilo y octanol, y prácticamente insoluble en agua. Las tabletas Starlix biconvex contienen 60 mg, o 120 mg, de nateglinida para administración oral.
Ingredientes inactivos: dióxido de silicio coloidal, croscarmelosa de sodio, hidroxipropilmetilcelulosa, óxidos de hierro (rojo o amarillo), lactosa monohidrato, estearato de magnesio, celulosa microcristalina, polietilenglicol, povidona, talco y titanio dióxido.
parte superior
Farmacología Clínica
Mecanismo de acción
La nateglinida es un derivado de aminoácidos que reduce los niveles de glucosa en la sangre al estimular la secreción de insulina del páncreas. Esta acción depende del funcionamiento de las células beta en los islotes pancreáticos. La nateglinida interactúa con el canal de potasio sensible al ATP (K + ATP) en las células beta pancreáticas. La posterior despolarización de la célula beta abre el canal de calcio, produciendo afluencia de calcio y secreción de insulina. El grado de liberación de insulina depende de la glucosa y disminuye a niveles bajos de glucosa. La nateglinida es altamente selectiva de tejidos con baja afinidad por el corazón y el músculo esquelético.
Farmacocinética
Absorción
Después de la administración oral inmediatamente antes de una comida, la nateglinida se absorbe rápidamente y las concentraciones plasmáticas máximas medias del fármaco (Cmax) generalmente ocurren dentro de 1 hora (Tmax) después de la dosificación. Cuando se administra a pacientes con diabetes tipo 2 en el rango de dosificación de 60 mg a 240 mg tres veces al día durante uno semana, la nateglinida demostró una farmacocinética lineal tanto para el AUC (área bajo la curva de tiempo / concentración plasmática) como para Cmax. Tmax también fue independiente de la dosis en esta población de pacientes. La biodisponibilidad absoluta se estima en aproximadamente el 73%. Cuando se administra con o después de las comidas, el grado de absorción de nateglinida (AUC) no se ve afectado. Sin embargo, hay una demora en la velocidad de absorción caracterizada por una disminución en la Cmáx y una demora en el tiempo para alcanzar la concentración plasmática máxima (Tmáx). Los perfiles plasmáticos se caracterizan por múltiples picos de concentración plasmática cuando se administra nateglinida en ayunas. Este efecto disminuye cuando se toma nateglinida antes de una comida.
Distribución
Según los datos que siguen a la administración intravenosa (IV) de nateglinida, el volumen de distribución en estado estacionario de nateglinida se estima en aproximadamente 10 litros en sujetos sanos. La nateglinida se une ampliamente (98%) a las proteínas séricas, principalmente a la albúmina sérica y, en menor medida, a la glicoproteína ácida \ alpha 1. La extensión de la unión a proteínas séricas es independiente de la concentración del fármaco en el rango de prueba de 0.1-10 µg / mL.
Metabolismo
La nateglinida es metabolizada por el sistema de oxidasa de función mixta antes de la eliminación. Las principales rutas del metabolismo son la hidroxilación seguida de la conjugación de glucurónidos. Los principales metabolitos son agentes antidiabéticos menos potentes que la nateglinida. El metabolito menor de isopreno posee una potencia similar a la del compuesto original nateglinida.
Los datos in vitro demuestran que la nateglinida se metaboliza predominantemente por las isoenzimas del citocromo P450 CYP2C9 (70%) y CYP3A4 (30%).
Excreción
La nateglinida y sus metabolitos se eliminan rápida y completamente después de la administración oral. Dentro de las 6 horas posteriores a la administración, aproximadamente el 75% de la 14C-nateglinida administrada se recuperó en la orina. El ochenta y tres por ciento de la 14C-nateglinida se excretó en la orina con un 10% adicional eliminado en las heces. Aproximadamente el 16% de la 14C-nateglinida se excretó en la orina como compuesto original. En todos los estudios de voluntarios sanos y pacientes con diabetes tipo 2, las concentraciones plasmáticas de nateglinida disminuyeron rápidamente con una vida media de eliminación promedio de aproximadamente 1,5 horas. De acuerdo con esta corta vida media de eliminación, no hubo acumulación aparente de nateglinida tras la administración múltiple de hasta 240 mg tres veces al día durante 7 días.
Interacciones con la drogas
Los estudios de metabolismo de fármacos in vitro indican que Starlix se metaboliza predominantemente por la isoenzima CYP2C9 del citocromo P450 (70%) y en menor medida por CYP3A4 (30%). Starlix es un inhibidor potencial de la isoenzima CYP2C9 in vivo, como lo indica su capacidad para inhibir el metabolismo in vitro de tolbutamida. La inhibición de las reacciones metabólicas del CYP3A4 no se detectó en experimentos in vitro.
Gliburida: en un estudio cruzado aleatorio de dosis múltiples, los pacientes con diabetes tipo 2 fueron administrado 120 mg de Starlix tres veces al día antes de las comidas durante 1 día en combinación con gliburida 10 mg diarios. No hubo alteraciones clínicamente relevantes en la farmacocinética de ninguno de los agentes.
Metformina: cuando se administró Starlix 120 mg tres veces al día antes de las comidas en combinación con metformina 500 mg tres veces al día a los pacientes con diabetes tipo 2, no hubo cambios clínicamente relevantes en la farmacocinética de agente.
Digoxina: cuando se administró Starlix 120 mg antes de las comidas en combinación con una dosis única de 1 mg de digoxina a voluntarios sanos, no hubo cambios clínicamente relevantes en la farmacocinética de ninguno de los dos agente.
Warfarina: cuando a sujetos sanos se les administró Starlix 120 mg tres veces al día antes de las comidas durante cuatro días en En combinación con una dosis única de warfarina 30 mg el día 2, no hubo alteraciones en la farmacocinética de ninguno de los dos. agente. El tiempo de protrombina no se vio afectado.
Diclofenaco: administración de dosis matutinas y de almuerzo de Starlix 120 mg en combinación con una sola dosis de 75 mg la dosis de diclofenaco en voluntarios sanos no produjo cambios significativos en la farmacocinética de ninguno de los dos agente.
Poblaciones Especiales
Geriátrico: la edad no influyó en las propiedades farmacocinéticas de nateglinida. Por lo tanto, no son necesarios ajustes de dosis para pacientes de edad avanzada.
Sexo: no se observaron diferencias clínicamente significativas en la farmacocinética de nateglinida entre hombres y mujeres. Por lo tanto, no es necesario ajustar la dosis en función del género.
Raza: Los resultados de un análisis farmacocinético poblacional que incluye sujetos de origen caucásico, negro y otros orígenes étnicos sugieren que la raza tiene poca influencia en la farmacocinética de nateglinida.
Insuficiencia renal: en comparación con sujetos sanos pareados, pacientes con diabetes tipo 2 y La insuficiencia renal de moderada a severa (CrCl 15-50 mL / min) que no está en diálisis mostró una aparente aparente aclaramiento, AUC y Cmax. Los pacientes con diabetes tipo 2 e insuficiencia renal en diálisis mostraron una exposición general reducida a los medicamentos. Sin embargo, los pacientes de hemodiálisis también experimentaron reducciones en la unión a proteínas plasmáticas en comparación con los voluntarios sanos compatibles.
Insuficiencia hepática: el pico y la exposición total de nateglinida en sujetos no diabéticos con insuficiencia hepática leve aumentaron en un 30% en comparación con sujetos sanos pareados. Starlix® (nateglinida) debe usarse con precaución en pacientes con enfermedad hepática crónica. (Ver PRECAUCIONES, Insuficiencia hepática).
Farmacodinámica
Starlix se absorbe rápidamente y estimula la secreción de insulina pancreática dentro de los 20 minutos posteriores a la administración oral. Cuando Starlix se dosifica tres veces al día antes de las comidas, hay un aumento rápido de la insulina plasmática, con niveles máximos aproximadamente 1 hora después de la dosificación y una caída hasta el nivel inicial a las 4 horas después de la dosificación.
En un ensayo clínico doble ciego controlado en el que se administró Starlix antes de cada uno de los tres comidas, los niveles de glucosa en plasma se determinaron durante un período de 12 horas durante el día después de 7 semanas de tratamiento. Starlix se administró 10 minutos antes de las comidas. Las comidas se basaron en menús de mantenimiento de peso diabético estándar con el contenido calórico total en función de la altura de cada sujeto. Starlix produjo disminuciones estadísticamente significativas en la glucemia en ayunas y posprandial en comparación con el placebo.
parte superior
Estudios clínicos
Un total de 3.566 pacientes fueron asignados al azar en nueve estudios doble ciego, controlados con placebo o activos de 8 a 24 semanas de duración para evaluar la seguridad y la eficacia de Starlix® (nateglinida). 3.513 pacientes tuvieron valores de eficacia más allá del valor basal. En estos estudios, se administró Starlix hasta 30 minutos antes de cada una de las tres comidas principales diarias.
Monoterapia Starlix® en comparación con placebo
En un estudio aleatorizado, doble ciego, controlado con placebo, de 24 semanas, pacientes con diabetes tipo 2 con HbA1C â ‰ ¥ 6.8% en la dieta sola se aleatorizaron para recibir Starlix (60 mg o 120 mg tres veces al día antes de las comidas) o placebo. La HbA1C basal osciló entre el 7,9% y el 8,1% y el 77,8% de los pacientes no habían recibido tratamiento antidiabético oral previamente. Los pacientes previamente tratados con medicamentos antidiabéticos debían suspender ese medicamento durante al menos 2 meses antes de la aleatorización. La adición de Starlix antes de las comidas dio como resultado reducciones estadísticamente significativas en la HbA1C media y la glucosa plasmática media en ayunas (FPG) en comparación con el placebo (ver Tabla 1). Las reducciones en HbA1C y FPG fueron similares para los pacientes ingenuos y los expuestos previamente a medicamentos antidiabéticos.
En este estudio, se informó un episodio de hipoglucemia severa (glucosa en plasma <36 mg / dL) en un paciente tratado con Starlix 120 mg tres veces al día antes de las comidas. Ningún paciente experimentó hipoglucemia que requiriera asistencia de terceros. Los pacientes tratados con Starlix tuvieron aumentos medios estadísticamente significativos en el peso en comparación con el placebo (ver Tabla 1).
En otro estudio aleatorizado, doble ciego, de 24 semanas, activo y controlado con placebo, los pacientes con diabetes tipo 2 fueron aleatorizados para recibir Starlix (120 mg tres veces diariamente antes de las comidas), metformina 500 mg (tres veces al día), una combinación de Starlix 120 mg (tres veces al día antes de las comidas) y metformina 500 mg (tres veces al día), o placebo. La HbA1C basal varió de 8.3% a 8.4%. El 57% de los pacientes no recibían tratamiento previo con terapia antidiabética oral. La monoterapia con Starlix dio como resultado reducciones significativas en la HbA1C media y la FPG media en comparación con el placebo que fueron similares a los resultados del estudio reportados anteriormente (ver Tabla 2).
Tabla 1: Resultados finales para un estudio de dosis fija de 24 semanas de monoterapia Starlix®
|
Placebo |
Starlix® 60 mg tres veces diario antes de las comidas |
Starlix® 120 mg tres veces diario antes de las comidas |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Línea de base (media) | 8.0 | 7.9 | 8.1 |
| Cambio desde el inicio (media) | +0.2 | -0.3 | -0.5 |
| Diferencia con placebo (media) | -0.5 un | -0.7 un | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Línea de base (media) | 167.9 | 161.0 | 166.5 |
| Cambio desde el inicio (media) | +9.1 | +0.4 | -4.5 |
| Diferencia con placebo (media) | -8.7 un | -13.6 un | |
| Peso (kg) | N = 170 | N = 169 | N = 166 |
| Línea de base (media) | 85.8 | 83.7 | 86.3 |
| Cambio desde el inicio (media) | -0.7 | +0.3 | +0.9 |
| Diferencia con placebo (media) | +1.0 un | +1.6 un |
un valor p â ‰ ¤ 0.004
Monoterapia Starlix® en comparación con otros agentes antidiabéticos orales
Gliburida
En un ensayo de 24 semanas, doble ciego, con control activo, pacientes con diabetes tipo 2 que habían estado bajo sulfonilurea durante 3 meses y que tenía un valor basal de HbA1C â ‰ ¥ 6.5% fueron aleatorizados para recibir Starlix (60 mg o 120 mg tres veces al día antes de las comidas) o gliburida 10 mg una vez diario. Los pacientes asignados al azar a Starlix tuvieron aumentos significativos en la HbA1C media y la FPG media en el punto final en comparación con los pacientes asignados al azar a gliburida.
Metformina
En otro estudio aleatorizado, doble ciego, de 24 semanas, activo y controlado con placebo, los pacientes con diabetes tipo 2 fueron aleatorizados para recibir Starlix (120 mg tres veces diariamente antes de las comidas), metformina 500 mg (tres veces al día), una combinación de Starlix 120 mg (tres veces al día antes de las comidas) y metformina 500 mg (tres veces al día), o placebo. La HbA1C basal varió de 8.3% a 8.4%. El 57% de los pacientes no recibían tratamiento previo con terapia antidiabética oral. Las reducciones en la HbA1C media y la FPG media en el punto final con monoterapia con metformina fueron significativamente mayores que las reducciones en estas variables con la monoterapia con Starlix (ver Tabla 2). En relación con el placebo, la monoterapia con Starlix se asoció con aumentos significativos en el peso medio, mientras que la monoterapia con metformina se asoció con disminuciones significativas en el peso medio. Entre el subconjunto de pacientes ingenuos a la terapia antidiabética, las reducciones en la HbA1C media y la FPG media para la monoterapia con Starlix fueron similares a las de la monoterapia con metformina (ver Tabla 2). Entre el subgrupo de pacientes previamente tratados con otros agentes antidiabéticos, principalmente gliburida, HbA1C en Starlix el grupo de monoterapia aumentó ligeramente desde el inicio, mientras que la HbA1C se redujo en el grupo de monoterapia con metformina (ver Tabla 2).
Terapia combinada de Starlix®
Metformina
En otro estudio aleatorizado, doble ciego, de 24 semanas, activo y controlado con placebo, los pacientes con diabetes tipo 2 fueron aleatorizados para recibir Starlix (120 mg tres veces diariamente antes de las comidas), metformina 500 mg (tres veces al día), una combinación de Starlix 120 mg (tres veces al día antes de las comidas) y metformina 500 mg (tres veces al día), o placebo. La HbA1C basal varió de 8.3% a 8.4%. El 57% de los pacientes no recibían tratamiento previo con terapia antidiabética oral. Los pacientes previamente tratados con medicamentos antidiabéticos debían suspender la medicación durante al menos 2 meses antes de la aleatorización. La combinación de Starlix y metformina dio como resultado reducciones estadísticamente significativas mayores en HbA1C y FPG en comparación con Starlix o metformina en monoterapia (ver Tabla 2). Starlix, solo o en combinación con metformina, redujo significativamente la elevación de glucosa prandial de antes de las comidas a 2 horas después de las comidas en comparación con el placebo y la metformina sola.
En este estudio, se informó un episodio de hipoglucemia severa (glucosa plasmática â ‰ ¤ 36 mg / dL) en un paciente que recibió el Se informó la combinación de Starlix y metformina y cuatro episodios de hipoglucemia severa en un solo paciente en la metformina brazo de tratamiento Ningún paciente experimentó un episodio de hipoglucemia que requirió asistencia de terceros. En comparación con el placebo, la monoterapia con Starlix se asoció con un aumento estadísticamente significativo en el peso, mientras que no se observó un cambio significativo en el peso con la terapia combinada de Starlix y metformina (ver Tabla 2).
En otro ensayo de 24 semanas, doble ciego, controlado con placebo, los pacientes con diabetes tipo 2 con HbA1C â ‰ ¥ 6.8% después del tratamiento con metformina (â ‰ ¥ 1500 mg diarios durante â ‰ ¥ 1 mes) ingresaron por primera vez en un período de cuatro semanas de monoterapia con metformina (2000 mg diarios) y luego aleatorizado para recibir Starlix (60 mg o 120 mg tres veces al día antes de las comidas) o placebo además de metformina. La terapia combinada con Starlix y metformina se asoció con reducciones estadísticamente significativamente mayores en HbA1C en comparación con la monoterapia con metformina (-0.4% y -0.6% para Starlix 60 mg y Starlix 120 mg más metformina, respectivamente).
Tabla 2: Resultados finales para un estudio de 24 semanas de monoterapia con Starlix® y combinación con metformina
|
Placebo |
Starlix® 120 mg tres veces diariamente antes comidas |
Metformina 500 mg tres veces diario |
Starlix® 120 mg antes de comidas más Metformina * |
|
| HbA1C (%) | ||||
| Todos | N = 160 | N = 171 | N = 172 | N = 162 |
| Línea de base (media) | 8.3 | 8.3 | 8.4 | 8.4 |
| Cambio desde el inicio (media) | +0.4 | -0.4 antes de Cristo | -0.8 C | -1.5 |
| Diferencia de placebo | -0.8 un | -1.2 un | -1.9 un | |
| NaÑ — ve | N = 98 | N = 99 | N = 98 | N = 81 |
| Línea de base (media) | 8.2 | 8.1 | 8.3 | 8.2 |
| Cambio desde el inicio (media) | +0.3 | -0.7 C | -0.8 C | -1.6 |
| Diferencia de placebo | -1.0 un | -1.1 un | -1.9 un | |
| No NaÑ — ve | N = 62 | N = 72 | N = 74 | N = 81 |
| Línea de base (media) | 8.3 | 8.5 | 8.7 | 8.7 |
| Cambio desde el inicio (media) | +0.6 | +0.004 antes de Cristo | -0.8 C | -1.4 |
| Diferencia de placebo | -0.6 un | -1.4 un | -2.0 un | |
| FPG (mg / dL) | ||||
| Todos | N = 166 | N = 173 | N = 174 | N = 167 |
| Línea de base (media) | 194.0 | 196.5 | 196.0 | 197.7 |
| Cambio desde el inicio (media) | +8.0 | -13.1 antes de Cristo | -30.0 C | -44.9 |
| Diferencia de placebo | -21.1 un | -38.0 un | -52.9 un | |
| Peso (kg) | ||||
| Todos | N = 160 | N = 169 | N = 169 | N = 160 |
| Línea de base (media) | 85.0 | 85.0 | 86.0 | 87.4 |
| Cambio desde el inicio (media) | -0.4 | +0.9 antes de Cristo | -0.1 | +0.2 |
| Diferencia de placebo | +1.3 un | +0.3 | +0.6 |
un valor p â ‰ ¤ 0.05 vs. placebo
b valor p â ‰ ¤ 0.03 vs. metformina
c valor p â ‰ ¤ 0.05 vs. combinación
* La metformina se administró tres veces al día.
Rosiglitazona
Se realizó un ensayo multicéntrico doble ciego de 24 semanas controlado con placebo en pacientes con Tipo 2 diabetes no controlada adecuadamente después de una respuesta terapéutica a la monoterapia con rosiglitazona 8 mg diario. La adición de Starlix (120 mg tres veces al día con las comidas) se asoció con reducciones estadísticamente significativamente mayores de HbA1C en comparación con la monoterapia con rosiglitazona. La diferencia fue -0.77% a las 24 semanas. El cambio medio en el peso desde el inicio fue de aproximadamente +3 kg para los pacientes tratados con Starlix más rosiglitazona versus aproximadamente +1 kg para los pacientes tratados con placebo más rosiglitazona.
Gliburida
En un estudio de 12 semanas de pacientes con diabetes tipo 2 controlados inadecuadamente con gliburida 10 mg una vez al día, la adición de Starlix (60 mg o 120 mg tres veces al día antes de las comidas) no produjo ningún adicional beneficio.
parte superior
Indicaciones y uso
Starlix® (nateglinida) está indicado como un complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2.
parte superior
Contraindicaciones
Starlix® (nateglinida) está contraindicado en pacientes con:
1. Hipersensibilidad conocida a la droga o sus ingredientes inactivos.
2. Diabetes tipo 1.
3. Cetoacidosis diabética. Esta condición debería ser tratada con insulina.
parte superior
Precauciones
Resultados macrovasculares: No se han realizado estudios clínicos que establezcan evidencia concluyente de reducción del riesgo macrovascular con Starlix o cualquier otro medicamento antidiabético.
Hipoglucemia: todos los medicamentos orales reductores de la glucosa en sangre que se absorben sistémicamente son capaces de producir hipoglucemia. La frecuencia de hipoglucemia está relacionada con la gravedad de la diabetes, el nivel de control glucémico y otras características del paciente. Los pacientes geriátricos, los pacientes desnutridos y aquellos con insuficiencia suprarrenal o pituitaria o insuficiencia renal grave son más susceptibles al efecto reductor de la glucosa de estos tratamientos. El riesgo de hipoglucemia puede incrementarse con ejercicio físico intenso, ingestión de alcohol, ingesta calórica insuficiente de forma aguda o crónica, o combinaciones con otros antidiabéticos orales agentes La hipoglucemia puede ser difícil de reconocer en pacientes con neuropatía autonómica y / o aquellos que usan betabloqueantes. Starlix® (nateglinida) debe administrarse antes de las comidas para reducir el riesgo de hipoglucemia. Los pacientes que omiten las comidas también deben omitir su dosis programada de Starlix para reducir el riesgo de hipoglucemia.
Insuficiencia hepática: Starlix debe usarse con precaución en pacientes con enfermedad hepática de moderada a grave porque dichos pacientes no han sido estudiados.
Pérdida de control glucémico
La pérdida transitoria del control glucémico puede ocurrir con fiebre, infección, trauma o cirugía. La terapia con insulina puede ser necesaria en lugar de la terapia Starlix en esos momentos. Puede producirse un fallo secundario o una eficacia reducida de Starlix durante un período de tiempo.
Información para pacientes
Se debe informar a los pacientes sobre los posibles riesgos y beneficios de Starlix y sobre los modos alternativos de terapia. Se deben explicar los riesgos y el manejo de la hipoglucemia. Se debe indicar a los pacientes que tomen Starlix de 1 a 30 minutos antes de ingerir una comida, pero que omitan su dosis programada si se saltan la comida para reducir el riesgo de hipoglucemia. Las interacciones farmacológicas deben discutirse con los pacientes. Se debe informar a los pacientes sobre posibles interacciones farmacológicas con Starlix.
Pruebas de laboratorio
La respuesta a las terapias debe evaluarse periódicamente con valores de glucosa y niveles de HbA1C.
Interacciones con la drogas
La nateglinida está altamente unida a las proteínas plasmáticas (98%), principalmente a la albúmina. Estudios de desplazamiento in vitro con fármacos altamente unidos a proteínas como furosemida, propranolol, captopril, nicardipina, pravastatina, gliburida, warfarina, fenitoína, ácido acetilsalicílico, tolbutamida y metformina no mostraron influencia en la extensión de la proteína nateglinida Unión. De manera similar, la nateglinida no tuvo influencia en la unión a proteínas séricas de propranolol, gliburida, nicardipina, warfarina, fenitoína, ácido acetilsalicílico y tolbutamida in vitro. Sin embargo, la evaluación prudente de casos individuales está garantizada en el entorno clínico.
Ciertos medicamentos, incluidos los agentes antiinflamatorios no esteroideos (AINE), salicilatos, inhibidores de la monoaminooxidasa y los agentes bloqueadores beta-adrenérgicos no selectivos pueden potenciar la acción hipoglucémica de Starlix y otros antidiabéticos orales drogas
Ciertos medicamentos que incluyen tiazidas, corticosteroides, productos tiroideos y simpaticomiméticos pueden reducir la acción hipoglucémica de Starlix y otros medicamentos antidiabéticos orales.
Cuando estos medicamentos se administran o se retiran de pacientes que reciben Starlix, se debe observar de cerca al paciente para detectar cambios en el control glucémico.
Interacciones medicamentosas / alimentarias
La farmacocinética de nateglinida no se vio afectada por la composición de una comida (alta en proteínas, grasas o carbohidratos). Sin embargo, los niveles plasmáticos máximos se redujeron significativamente cuando se administró Starlix 10 minutos antes de una comida líquida. Starlix no tuvo ningún efecto sobre el vaciado gástrico en sujetos sanos según lo evaluado por las pruebas de acetaminofén.
Carcinogénesis / Mutagénesis / Deterioro de la Fertilidad
Carcinogenicidad: se realizó un estudio de carcinogenicidad de dos años en ratas Sprague-Dawley con dosis orales de nateglinida de hasta 900 mg / kg / día, lo que produjo exposiciones AUC en ratas machos y hembras aproximadamente 30 y 40 veces la exposición terapéutica humana, respectivamente, con una dosis recomendada de Starlix de 120 mg, tres veces al día antes comidas Se realizó un estudio de carcinogenicidad de dos años en ratones B6C3F1 con dosis orales de nateglinida de hasta 400 mg / kg / día, lo que produjo exposiciones AUC en machos y ratones hembra aproximadamente 10 y 30 veces la exposición terapéutica humana con una dosis recomendada de Starlix de 120 mg, tres veces al día antes de las comidas. No se encontró evidencia de una respuesta tumorigénica ni en ratas ni en ratones.
Mutagénesis: la nateglinida no fue genotóxica en la prueba in vitro de Ames, el ensayo de linfoma de ratón, el ensayo de aberración cromosómica en células de pulmón de hámster chino o en la prueba de micronúcleo de ratón in vivo.
Deterioro de la fertilidad: la administración de nateglinida a las ratas no afectó la fertilidad a dosis de hasta 600 mg / kg (aproximadamente 16 veces la exposición terapéutica humana con una dosis recomendada de Starlix de 120 mg tres veces al día antes comidas).
El embarazo
Embarazo Categoría C
La nateglinida no fue teratogénica en ratas a dosis de hasta 1000 mg / kg (aproximadamente 60 veces la exposición terapéutica humana con una dosis recomendada de Starlix de 120 mg, tres veces al día antes de las comidas). En el conejo, el desarrollo embrionario se vio afectado negativamente y la incidencia de agenesia de la vesícula biliar o vesícula biliar pequeña aumentó a un dosis de 500 mg / kg (aproximadamente 40 veces la exposición terapéutica humana con una dosis recomendada de Starlix de 120 mg, tres veces al día antes comidas). No existen estudios adecuados y bien controlados en mujeres embarazadas. Starlix no debe usarse durante el embarazo.
Trabajo y entrega
Se desconoce el efecto de Starlix sobre el parto y el parto en humanos.
Madres lactantes
Los estudios en ratas lactantes mostraron que la nateglinida se excreta en la leche; la relación AUC0-48h en leche a plasma fue de aproximadamente 1: 4. Durante el período peri y postnatal, los pesos corporales fueron menores en las crías de ratas que recibieron nateglinida a 1000 mg / kg (aproximadamente 60 veces la exposición terapéutica humana con una dosis recomendada de Starlix de 120 mg, tres veces al día antes comidas). No se sabe si Starlix se excreta en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana, Starlix no debe administrarse a una mujer lactante.
Uso pediátrico
No se ha establecido la seguridad y eficacia de Starlix en pacientes pediátricos.
Uso geriátrico
No se observaron diferencias en la seguridad o eficacia de Starlix entre los pacientes de 65 años o más y los menores de 65 años. Sin embargo, no se puede descartar una mayor sensibilidad de algunas personas mayores a la terapia Starlix.
parte superior
Reacciones adversas
En ensayos clínicos, aproximadamente 2.600 pacientes con diabetes tipo 2 fueron tratados con Starlix® (nateglinida). De estos, aproximadamente 1.335 pacientes fueron tratados durante 6 meses o más y aproximadamente 190 pacientes durante un año o más.
La hipoglucemia fue relativamente poco frecuente en todos los brazos de tratamiento de los ensayos clínicos. Solo el 0.3% de los pacientes de Starlix interrumpieron debido a hipoglucemia. Los síntomas gastrointestinales, especialmente la diarrea y las náuseas, no fueron más comunes en los pacientes que usaron la combinación de Starlix y metformina que en los pacientes que recibieron metformina sola. Del mismo modo, el edema periférico no fue más común en pacientes que usaron la combinación de Starlix y rosiglitazona que en pacientes que recibieron rosiglitazona sola. La siguiente tabla enumera los eventos que ocurrieron con mayor frecuencia en pacientes Starlix que en pacientes con placebo en ensayos clínicos controlados.
Eventos adversos comunes (â ‰ ¥ 2% en pacientes Starlix®) en ensayos de monoterapia Starlix® (% de pacientes)
| Placebo | Starlix® | |
| N = 458 | N = 1441 | |
| Término preferido | ||
| Infeccion de las vias respiratorias altas | 8.1 | 10.5 |
| Dolor de espalda | 3.7 | 4.0 |
| Sintomas de gripe | 2.6 | 3.6 |
| Mareo | 2.2 | 3.6 |
| Artropatía | 2.2 | 3.3 |
| Diarrea | 3.1 | 3.2 |
| Trauma accidental | 1.7 | 2.9 |
| Bronquitis | 2.6 | 2.7 |
| Tos | 2.2 | 2.4 |
| Hipoglucemia | 0.4 | 2.4 |
Durante la experiencia posterior a la comercialización, se han informado casos raros de reacciones de hipersensibilidad como erupción cutánea, picazón y urticaria. Del mismo modo, se han informado casos de ictericia, hepatitis colestásica y elevación de las enzimas hepáticas.
Anomalías de laboratorio
Ácido úrico: Hubo aumentos en los niveles medios de ácido úrico para pacientes tratados con Starlix solo, Starlix en combinación con metformina, metformina sola y gliburida sola. Las diferencias respectivas con respecto al placebo fueron 0.29 mg / dL, 0.45 mg / dL, 0.28 mg / dL y 0.19 mg / dL. La importancia clínica de estos hallazgos es desconocida.
parte superior
Sobredosis
En un estudio clínico en pacientes con diabetes tipo 2, se administró Starlix® (nateglinida) en dosis crecientes hasta 720 mg por día durante 7 días y no hubo eventos adversos clínicamente significativos reportado. No ha habido casos de sobredosis con Starlix en ensayos clínicos. Sin embargo, una sobredosis puede dar como resultado un efecto exagerado de disminución de la glucosa con el desarrollo de síntomas de hipoglucemia. Los síntomas de hipoglucemia sin pérdida de conciencia o hallazgos neurológicos deben tratarse con glucosa oral y ajustes en los patrones de dosificación y / o comida. Las reacciones hipoglucémicas graves con coma, convulsiones u otros síntomas neurológicos deben tratarse con glucosa intravenosa. Como la nateglinida está altamente unida a proteínas, la diálisis no es un medio eficaz para eliminarla de la sangre.
parte superior
Dosificación y administración
Starlix® (nateglinida) debe tomarse de 1 a 30 minutos antes de las comidas.
Monoterapia y combinación con metformina o una tiazolidindiona
La dosis recomendada de inicio y mantenimiento de Starlix, sola o en combinación con metformina o una tiazolidindiona, es de 120 mg tres veces al día antes de las comidas.
La dosis de 60 mg de Starlix, ya sea sola o en combinación con metformina o una tiazolidindiona, puede usarse en pacientes que están cerca de la meta de HbA1C cuando se inicia el tratamiento.
Dosis en pacientes geriátricos
No suelen ser necesarios ajustes de dosis especiales. Sin embargo, no se puede descartar una mayor sensibilidad de algunas personas a la terapia Starlix.
Posología en insuficiencia renal y hepática
No es necesario ajustar la dosis en pacientes con insuficiencia renal de leve a grave o en pacientes con insuficiencia hepática leve. No se ha estudiado la dosificación de pacientes con disfunción hepática de moderada a grave. Por lo tanto, Starlix debe usarse con precaución en pacientes con enfermedad hepática de moderada a grave (ver PRECAUCIONES, Insuficiencia hepática).
parte superior
Cómo suministrado
Tabletas de Starlix® (nateglinida)
60 mg
Tableta con borde biselado, redondo, rosa con "Starlix" grabado en un lado y "60" en el otro.
Botellas de 100... NDC 0078-0351-05
120 mg
Comprimido ovalado amarillo con "Starlix" grabado en un lado y "120" en el otro.
Botellas de 100... NDC 0078-0352-05
Almacenamiento
Almacenar a 25 ºC (77 ºF); excursiones permitidas a 15 ºC-30 ºC (59 ºF-86 ºF).
Dispensar en un recipiente hermético, USP.
T2008-01
REV: JULIO 2008
Fabricado por:
Novartis Pharma Stein AG
Stein, Suiza
DISTRIBUIDO por:
Corporación Farmacéutica Novartis
East Hanover, Nueva Jersey 07936
© Novartis
Última actualización 07/2008
Starlix, nateglinida, información completa del paciente (en inglés simple)
Información detallada sobre signos, síntomas, causas, tratamientos de diabetes
La información en esta monografía no pretende cubrir todos los usos, instrucciones, precauciones, interacciones de drogas o efectos adversos posibles. Esta información es generalizada y no pretende ser un consejo médico específico. Si tiene preguntas sobre los medicamentos que está tomando o desea obtener más información, consulte con su médico, farmacéutico o enfermero.
de regreso: Ver todos los medicamentos para la diabetes



