Exubera para el tratamiento de la diabetes
Nombre de la marca: Exubera
Nombre genérico: insulina humana
Forma de dosificación: polvo de inhalación
Contenido:
Descripción
Farmacología Clínica
Estudios clínicos
Indicaciones y uso
Contraindicaciones
Advertencias
Precauciones
Interacciones con la drogas
Reacciones adversas
Sobredosis
Dosificación y administración
Cómo suministrado
Exubera, insulina humana [origen ADNr] Información para el paciente (en inglés simple)
Descripción
Exubera® consiste en ampollas que contienen polvo de inhalación de insulina humana, que se administran con Exubera® Inhalador. Las ampollas de Exubera contienen insulina humana producida por tecnología de ADN recombinante que utiliza una cepa de laboratorio no patógena de Escherichia coli (K12). Químicamente, la insulina humana tiene la fórmula empírica C257H383norte65O77S6 y un peso molecular de 5808. La insulina humana tiene la siguiente secuencia de aminoácidos primaria:

El polvo de inhalación de exubera (insulina humana [ADNr]) es un polvo blanco a blanquecino en una ampolla de dosis unitaria (llene la masa, consulte la Tabla 1). Cada blister de dosis unitaria de Exubera contiene una dosis de insulina de 1 mg o 3 mg (ver Tabla 1) en un formulación en polvo homogénea que contiene citrato de sodio (dihidrato), manitol, glicina y sodio hidróxido. Después de insertar una ampolla Exubera en el inhalador, el paciente bombea el asa del inhalador y luego presiona un botón, haciendo que la ampolla se perfore. El polvo de inhalación de insulina se dispersa en la cámara, lo que permite al paciente inhalar el polvo en aerosol.
Bajo condiciones estandarizadas de prueba in vitro, Exubera administra una dosis específica de insulina emitida desde la boquilla del inhalador (ver Tabla 1). Una fracción de la masa total de partículas se emite como partículas finas capaces de alcanzar el pulmón profundo. Hasta el 45% del contenido de la ampolla de 1 mg, y hasta el 25% del contenido de la ampolla de 3 mg, se puede retener en la ampolla.
Tabla 1: Nomenclatura de dosis e información
| Llenar masa (mg de polvo) |
Dosis nominal (mg de insulina) |
Dosis emitida*,†(mg de insulina) |
Dosis de partículas finasC,†(mg de insulina) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
La cantidad real de insulina administrada al pulmón dependerá de factores individuales del paciente, como el perfil de flujo inspiratorio. In vitro, las mediciones de aerosoles emitidos no se ven afectadas a caudales superiores a 10 l / min.
parte superior
Farmacología Clínica
Mecanismo de acción
La actividad principal de la insulina es la regulación del metabolismo de la glucosa. La insulina reduce las concentraciones de glucosa en la sangre al estimular la absorción periférica de glucosa por el músculo esquelético y la grasa, e inhibiendo la producción de glucosa hepática. La insulina inhibe la lipólisis en el adipocito, inhibe la proteólisis y mejora la síntesis de proteínas.
Farmacocinética
Absorción
Exubera administra insulina por inhalación oral. La insulina se absorbe tan rápido como los análogos de insulina de acción rápida administrados por vía subcutánea y más rápidamente que insulina humana regular administrada por vía subcutánea en sujetos sanos y en pacientes con diabetes tipo 1 o tipo 2 (ver Figura 1).
Figura 1: Cambios medios en las concentraciones de suero de insulina libre (µU / ml) en pacientes con diabetes tipo 2 después de Administración de dosis únicas de insulina inhalada de Exubera (6 mg) e insulina humana regular subcutánea (18U)

En estudios clínicos en pacientes con diabetes tipo 1 y tipo 2, después de la inhalación de Exubera, la insulina sérica alcanzó la concentración máxima más rápidamente que después de la inyección subcutánea de insulina humana regular, 49 minutos (rango de 30 a 90 minutos) en comparación con 105 minutos (rango de 60 a 240 minutos), respectivamente.
En estudios clínicos, la absorción de insulina humana regular subcutánea disminuyó con el aumento del índice de masa corporal (IMC) del paciente. Sin embargo, la absorción de insulina después de la inhalación de Exubera fue independiente del IMC.
En un estudio en sujetos sanos, la exposición sistémica a la insulina (AUC y Cmax) después de la administración de Exubera aumentó con la dosis en un rango de 1 a 6 mg cuando se administra como combinaciones de 1 y 3 mg. ampollas
En un estudio donde se comparó la forma de dosificación de tres ampollas de 1 mg con una ampolla de 3 mg, Cmax y AUC después de la administración de tres ampollas de 1 mg fueron aproximadamente 30% y 40% mayores, respectivamente, que después de la administración de una ampolla de 3 mg (ver DOSIFICACIÓN Y ADMINISTRACIÓN).
Distribución y Eliminación
Debido a que la insulina humana recombinante es idéntica a la insulina endógena, se espera que la distribución sistémica y la eliminación sean las mismas. Sin embargo, esto no ha sido confirmado para Exubera.
Farmacodinámica
Exubera, como los análogos de insulina de acción rápida administrados por vía subcutánea, tiene un inicio más rápido de actividad reductora de la glucosa que la insulina humana regular administrada por vía subcutánea. En voluntarios sanos, la duración de la actividad reductora de glucosa para Exubera fue comparable a la subcutánea administró insulina humana regular y más tiempo que los análogos de insulina de acción rápida administrados por vía subcutánea (ver Figura 2).
Figura 2. Velocidad media de infusión de glucosa (GIR) normalizada a GIRmax para cada sujeto Tratamiento versus tiempo en voluntarios sanos

* Determinado como la cantidad de glucosa infundida para mantener concentraciones constantes de glucosa en plasma, normalizada a valores máximos (porcentaje de valores máximos); indicativo de actividad de insulina.
Cuando se inhala Exubera, el inicio de la actividad reductora de la glucosa en voluntarios sanos se produce en 10-20 minutos. El efecto máximo sobre la disminución de la glucosa se ejerce aproximadamente 2 horas después de la inhalación. La duración de la actividad reductora de glucosa es de aproximadamente 6 horas.
En pacientes con diabetes tipo 1 o tipo 2, Exubera tiene un mayor efecto reductor de glucosa dentro de las primeras dos horas después de la dosificación en comparación con la insulina humana regular administrada por vía subcutánea.
La variabilidad intra-sujeto de la actividad reductora de glucosa de Exubera es generalmente comparable a la de la insulina humana regular administrada por vía subcutánea en pacientes con diabetes tipo 1 y 2.
Poblaciones Especiales
Pacientes pediátricos
En niños (6-11 años) y adolescentes (12-17 años) con diabetes tipo 1, el tiempo hasta la concentración máxima de insulina para Exubera fue logrado más rápido que para la insulina humana regular subcutánea, que es consistente con las observaciones en pacientes adultos con tipo 1 diabetes.
Pacientes geriátricos
No hay diferencias aparentes en las propiedades farmacocinéticas de Exubera cuando se comparan pacientes mayores de 65 años y pacientes adultos más jóvenes.
Género
En sujetos con y sin diabetes, no se observaron diferencias aparentes en las propiedades farmacocinéticas de Exubera entre hombres y mujeres.
Carrera
Se realizó un estudio en 25 sujetos no diabéticos sanos caucásicos y japoneses para comparar Propiedades farmacocinéticas y farmacodinámicas de Exubera, versus inyección subcutánea de humanos normales insulina. Las propiedades farmacocinéticas y farmacodinámicas de Exubera fueron comparables entre las dos poblaciones.
Obesidad
La absorción de Exubera es independiente del IMC del paciente.
Insuficiencia renal
No se ha estudiado el efecto de la insuficiencia renal sobre la farmacocinética de Exubera. La monitorización cuidadosa de la glucosa y los ajustes de dosis de insulina pueden ser necesarios en pacientes con disfunción renal (ver PRECAUCIONES, Insuficiencia renal).
Deterioro hepático
No se ha estudiado el efecto de la insuficiencia hepática en la farmacocinética de Exubera. La monitorización cuidadosa de la glucosa y los ajustes de dosis de insulina pueden ser necesarios en pacientes con disfunción hepática (ver PRECAUCIONES).
El embarazo
La absorción de Exubera en pacientes embarazadas con diabetes tipo 2 gestacional y pregestacional fue consistente con la de pacientes no embarazadas con diabetes tipo 2 (ver PRECAUCIONES).
De fumar
En los fumadores, se espera que la exposición sistémica a la insulina para Exubera sea de 2 a 5 veces mayor que en los no fumadores. Exubera está contraindicado en pacientes que fuman o que han dejado de fumar menos de 6 meses antes de comenzar la terapia con Exubera. Si un paciente comienza o vuelve a fumar, Exubera debe suspenderse inmediatamente debido al mayor riesgo de hipoglucemia, y debe utilizarse un tratamiento alternativo (ver CONTRAINDICACIONES).
En estudios clínicos de Exubera en 123 pacientes (69 de los cuales eran fumadores), los fumadores experimentaron un inicio más rápido de acción reductora de la glucosa, mayor efecto máximo, y un mayor efecto de reducción de glucosa total (particularmente durante las primeras 2-3 horas después de la dosificación), en comparación con no fumadores
Humo pasivo de cigarrillos
En contraste con el aumento de la exposición a la insulina después del tabaquismo activo, cuando se administró Exubera a 30 voluntarios sanos no fumadores después de 2 horas de exposición al humo de cigarrillo pasivo en un entorno experimental controlado, el AUC y la Cmáx de la insulina se redujeron en aproximadamente un 20% y un 30%, respectivamente. La farmacocinética de Exubera no se ha estudiado en no fumadores que están expuestos crónicamente al humo de cigarrillo pasivo.
Pacientes con enfermedades pulmonares subyacentes
No se recomienda el uso de Exubera en pacientes con enfermedad pulmonar subyacente, como asma o EPOC, porque no se ha establecido la seguridad y eficacia de Exubera en esta población (ver Advertencias). El uso de Exubera está contraindicado en pacientes con enfermedad pulmonar inestable o mal controlada, debido a variaciones en la función pulmonar que podrían afectar la absorción de Exubera y aumentar el riesgo de hipoglucemia o hiperglucemia (ver CONTRAINDICACIONES).
En un estudio farmacocinético en 24 sujetos no diabéticos con asma leve, la absorción de insulina después de la administración de Exubera, en ausencia de tratamiento con un broncodilatador, fue aproximadamente un 20% menor que la absorción observada en sujetos sin asma. Sin embargo, en un estudio en 24 sujetos no diabéticos con enfermedad pulmonar obstructiva crónica (EPOC), la enfermedad sistémica la exposición después de la administración de Exubera fue aproximadamente dos veces mayor que la de sujetos normales sin EPOC (ver PRECAUCIONES).
Administración de albuterol 30 minutos antes de la administración de Exubera en sujetos no diabéticos con asma leve (n = 36) y moderada El asma (n = 31) dio como resultado un aumento medio en el AUC y la Cmáx de insulina de entre 25 y 50% en comparación con cuando Exubera se administró solo (ver PRECAUCIONES).
parte superior
Estudios clínicos
La seguridad y eficacia de Exubera se ha estudiado en aproximadamente 2500 pacientes adultos con diabetes tipo 1 y tipo 2. El parámetro primario de eficacia para la mayoría de los estudios fue el control glucémico, medido por la reducción desde el inicio en la hemoglobina A1c (HbA1c).
Diabetes tipo 1
Se realizó un estudio aleatorizado, abierto, de control activo de 24 semanas (Estudio A) en pacientes con diabetes tipo 1 para evaluar la seguridad y la eficacia de Exubera administró antes de las comidas tres veces al día (TID) con una sola inyección nocturna de Humulin® U Ultralente® (suspensión de zinc prolongado con insulina humana) (n = 136). El tratamiento de comparación fue insulina humana regular subcutánea administrada dos veces al día (BID) (antes del desayuno y antes de la cena) con inyección BID de insulina humana NPH (suspensión de insulina isofánica humana) (n = 132) En este estudio, la edad media fue de 38,2 años (rango: 20-64) y el 52% de los sujetos eran hombres.
Se realizó un segundo estudio aleatorizado, abierto, de control activo de 24 semanas (Estudio B) en pacientes con diabetes tipo 1 para evaluar el seguridad y eficacia de Exubera (n = 103) en comparación con la insulina humana regular subcutánea (n = 103) cuando se administra TID antes de comidas En ambos brazos de tratamiento, la insulina humana NPH se administró BID (por la mañana y antes de acostarse) como la insulina basal. En este estudio, la edad media fue de 38,4 años (rango: 19-65) y el 54% de los sujetos eran hombres.
En cada estudio, la reducción de HbA1c y las tasas de hipoglucemia fueron comparables para los dos grupos de tratamiento. Los pacientes tratados con Exubera tuvieron una mayor reducción en la glucosa plasmática en ayunas que los pacientes en el grupo de comparación. El porcentaje de pacientes que alcanzan un nivel de HbA1c de <8% (por acción de tratamiento de la American Diabetes Association Nivel en el momento de la realización del estudio) y un nivel de HbA1c <7% fue comparable entre los dos grupos de tratamiento. Los resultados de los Estudios A y B se muestran en la Tabla 2.
Tabla 2: Resultados de dos ensayos abiertos, de control activo y abierto de 24 semanas en pacientes con diabetes tipo 1 (estudios A y B)
| Estudio A | Estudio B | |||
|---|---|---|---|---|
| Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) | Exubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Tamaño de la muestra | 136 | 132 | 103 | 103 |
| UL = Humulina® U Ultralente®; SC R = insulina humana regular subcutánea | ||||
| ||||
| HbA1c (%) | ||||
| Media basal | 7.9 | 8.0 | 7.8 | 7.8 |
| Adj. cambio medio desde el inicio | -0.2 | -0.4 | -0.3 | -0.2 |
| Exubera menos SC R* | 0.14 | -0.11 | ||
| IC 95% para diferencia de tratamiento | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Glucosa en plasma en ayunas (mg / dL) | ||||
| Media basal | 191 | 198 | 178 | 191 |
| Adj. cambio medio desde el inicio | -32 | -6 | -23 | 13 |
| Exubera menos SC R | -27 | -35 | ||
| IC 95% para diferencia de tratamiento | (-47, -6) | (-58, -13) | ||
| Concentración de glucosa posprandial de 2 horas (mg / dL) | ||||
| Media basal | 283 | 305 | 273 | 293 |
| Adj. cambio medio desde el inicio | -21 | 14 | -1 | -3 |
| Exubera menos SC R | -35 | 2 | ||
| IC 95% para diferencia de tratamiento | (-61, -8) | (-29, 32) | ||
| Pacientes con HbA al final del estudio1c < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Pacientes con HbA al final del estudio1c < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Peso corporal | ||||
| Media basal (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Adj. cambio medio respecto al valor basal (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Exubera menos SC R | -0.72 | -0.24 | ||
| IC 95% para diferencia de tratamiento | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Fin de estudio dosis diaria de insulina | ||||
| Insulina de acción corta | 13,4 mgC | 18,3 UI | 10,9 mgC | 25,7 UI |
| Insulina de acción prolongada | 26,4 UI | 37,1 UI | 31,5 UI | 31,9 UI |
Diabetes tipo 2
Monoterapia en pacientes no controlados de manera óptima con dieta y tratamiento con ejercicio
Se realizó un estudio aleatorizado, abierto, de control activo de 12 semanas (Estudio C) en pacientes con diabetes tipo 2 no óptima controlado con dieta y ejercicio, evaluando la seguridad y eficacia de Exubera TID antes de las comidas (n = 75) en comparación con un agente sensibilizador de insulina. En este estudio, la edad promedio fue de 53.7 años (rango: 28-80), el 55% de los sujetos eran hombres y el índice de masa corporal promedio fue de 32.3 kg / m2.
A las 12 semanas, HbA1c los niveles en pacientes tratados con Exubera disminuyeron 2.2% (SD = 1.0) desde una línea de base de 9.5% (SD = 1.1). La proporción de pacientes tratados con Exubera que alcanzan una HbA al final del estudio1c nivel de <8% aumentado a 82.7%. La proporción de pacientes tratados con Exubera que alcanzan una HbA al final del estudio1c nivel de
Monoterapia y terapia complementaria en pacientes tratados previamente con terapia de agente oral
Se realizó un estudio aleatorizado, abierto, de control activo de 12 semanas (Estudio D) en pacientes con tipo 2 diabetes que estaban recibiendo tratamiento actualmente, pero estaban mal controladas, con dos agentes orales (OA) Los OA iniciales incluyeron un secretagogo de insulina y metformina o tiazolidindiona. Los pacientes fueron asignados al azar a uno de los tres brazos: continuar la terapia de OA sola (n = 96), cambiar a monoterapia con Exubera TID antes de las comidas (n = 102) o agregando Exubera TID antes de las comidas a la terapia continua de OA (n = 100). En este estudio, la edad promedio fue de 57.4 años (rango: 33-80), el 66% de los sujetos eran hombres y el índice de masa corporal promedio fue de 30 kg / m2.
La monoterapia con Exubera y Exubera en combinación con la terapia de OA fueron superiores a la terapia de OA sola para reducir la HbA1c niveles desde el inicio. Las tasas de hipoglucemia para los dos grupos de tratamiento con Exubera fueron ligeramente más altas que en el grupo de tratamiento con OA solo. En comparación con la terapia de OA sola, el porcentaje de pacientes que alcanzan una HbA1c nivel de <8% (por nivel de acción de tratamiento de la Asociación Americana de Diabetes en el momento de la realización del estudio) y una HbA1c el nivel de <7% fue mayor para los pacientes tratados con Exubera en monoterapia y Exubera en combinación con terapia de OA. Los pacientes en ambos grupos de tratamiento con Exubera tuvieron mayores reducciones en la glucosa plasmática en ayunas que los pacientes tratados con terapia de OA sola. Los resultados para el Estudio D se muestran en la Tabla 3.
Tabla 3: Resultados de un ensayo abierto, de control activo y abierto de 12 semanas en pacientes con diabetes tipo 2 que no se controla de manera óptima con la terapia con agentes orales dobles (Estudio D)
| Estudio d | Exubera en monoterapia | OAs* | Exubera + OAs |
|---|---|---|---|
| Tamaño de la muestra | 102 | 96 | 100 |
| |||
| HbA1c (%) | |||
| Media basal | 9.3 | 9.3 | 9.2 |
| Adj. cambio medio desde el inicio | -1.4 | -0.2 | -1.9 |
| Grupo Exubera menos OAs†| -1.18†,C, § | -1.67†, ¶, § | |
| IC 95% para diferencia de tratamiento | (-1.41, -0.95) | (-1.90, -1.44) | |
| Glucosa en plasma en ayunas (mg / dL) | |||
| Media basal | 203 | 203 | 195 |
| Adj. cambio medio desde el inicio | -23 | 1 | -53 |
| Grupo Exubera menos OAs | -24C | -53 ¶ | |
| IC 95% para diferencia de tratamiento | (-36, -11) | (-66, -41) | |
| Pacientes con HbA al final del estudio1c < 8%# | 55.9% | 18.8% | 86.0% |
| Pacientes con HbA al final del estudio1c < 7% | 16.7% | 1.0% | 32.0% |
| Peso corporal | |||
| Media basal (kg) | 89.5 | 88.0 | 88.6 |
| Adj. cambio medio respecto al valor basal (kg) | 2.8 | 0.0 | 2.7 |
| Grupo Exubera menos OAs | 2.80C | 2.75 ¶ | |
| IC 95% para diferencia de tratamiento | (1.94, 3.65) | (1.89, 3.61) |
Se realizó un estudio aleatorizado, abierto, de control activo de 24 semanas (Estudio E) en pacientes con diabetes tipo 2, que actualmente reciben terapia con sulfonilurea. Este estudio fue diseñado para evaluar la seguridad y eficacia de la adición de Exubera antes de las comidas para continuar terapia con sulfonilurea (n = 214) en comparación con la adición de metformina antes de las comidas a la terapia continua con sulfonilurea (n = 196). Los sujetos fueron estratificados de acuerdo con su HbA1c en la semana -1. Se definieron dos estratos: un estrato bajo de HbA1c (HbA1c â ‰ ¥ 8% a â ‰ ¤9.5%) y una HbA alta1c estrato (HbA1c > 9.5 a â ‰ ¤12%).
Exubera en combinación con sulfonilurea fue superior a metformina y sulfonilurea en la reducción de los valores de HbA1c desde el inicio en el grupo de estrato alto. La exubera en combinación con sulfonilurea fue comparable a la metformina en combinación con sulfonilurea en la reducción de los valores de HbA1c desde el inicio en el grupo de bajo estrato. La tasa de hipoglucemia fue mayor después de la adición de Exubera a la sulfonilurea que después de la adición de metformina a la sulfonilurea. El porcentaje de pacientes que alcanzaron valores objetivo de HbA1c de 8% y 7% fue comparable entre los grupos de tratamiento en ambos estratos, al igual que la reducción de la glucosa plasmática en ayunas (ver Tabla 4).
Se realizó otro estudio aleatorizado, abierto, de control activo de 24 semanas (Estudio F) en pacientes con diabetes tipo 2, que actualmente reciben terapia con metformina. Este estudio fue diseñado para evaluar la seguridad y eficacia de la adición de Exubera antes de las comidas para continuar tratamiento con metformina (n = 234) en comparación con la adición de glibenclamida antes de las comidas al tratamiento continuo con metformina (n = 222). Los sujetos en este estudio también fueron estratificados a uno de dos estratos como se define en el Estudio E.
Exubera en combinación con metformina fue superior a la glibenclamida y la metformina en la reducción de HbA1c valores desde el inicio y alcanzar el objetivo de HbA1c valores en el grupo de alto estrato. Exubera en combinación con metformina fue comparable a la glibenclamida en combinación con metformina para reducir la HbA1c valores desde el inicio y alcanzar el objetivo de HbA1c valores en el grupo de estrato bajo. La tasa de hipoglucemia fue ligeramente mayor después de la adición de Exubera a la metformina que después de la adición de glibenclamida a la metformina. La reducción de la glucosa plasmática en ayunas fue comparable entre los grupos de tratamiento (ver Tabla 4).
Tabla 4: Resultados de dos ensayos abiertos, de control activo, de 24 semanas en pacientes con diabetes tipo 2 previamente en terapia con agentes orales (estudios E y F)
| Estudio E | Estudio F | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | Reunió*+ SU* | Exubera + SU* | Reunió*+ SU* | Exubera + Met* | Gli* + Met* | Exubera + Met* | Gli* + Met* | |
| Alto estrato†| Estrato bajo†| Alto estrato†| Estrato bajo†| |||||
| Tamaño de la muestra | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1c (%) | ||||||||
| Media basal | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Adj. cambio medio desde el inicio | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera menos OAC | -0.38C, § | -0.07 | -0.37C, ¶ | 0.04 | ||||
| IC 95% para diferencia de tratamiento | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Glucosa en plasma en ayunas (mg / dL) | ||||||||
| Media basal | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Cambio medio desde el inicio | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera menos OA | 1 | 4 | -2 | 4 | ||||
| IC 95% para diferencia de tratamiento | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Sujetos con HbA al final del estudio1c < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Sujetos con HbA al final del estudio1c < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Peso corporal | ||||||||
| Media basal (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Adj. cambio medio respecto al valor basal (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera menos OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| IC 95% para diferencia de tratamiento | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Uso en pacientes tratados previamente con insulina subcutánea
Se realizó un estudio aleatorizado, abierto, de control activo de 24 semanas (Estudio G) en pacientes tratados con insulina con tipo 2 diabetes para evaluar la seguridad y la eficacia de TID administrado antes de las comidas con una única inyección nocturna de Exubera Humulina® U Ultralente® (n = 146) en comparación con la BID administrada con insulina humana subcutánea regular (antes del desayuno y antes de la cena) con la inyección BID de insulina humana NPH (n = 149). En este estudio, la edad promedio fue de 57.5 años (rango: 23-80), el 66% de los sujetos eran hombres y el índice de masa corporal promedio fue de 30.3 kg / m2.
Las reducciones de la línea base en HbA1c, porcentaje de pacientes que alcanzan una HbA1c nivel de <8% (por nivel de acción de tratamiento de la Asociación Americana de Diabetes en el momento de la realización del estudio) y una HbA1c El nivel de <7%, así como las tasas de hipoglucemia, fueron similares entre los grupos de tratamiento. Los pacientes tratados con Exubera tuvieron una mayor reducción en la glucosa plasmática en ayunas que los pacientes en el grupo de comparación. Los resultados para el Estudio G se muestran en la Tabla 5.
Tabla 5: Resultados de un ensayo abierto, de control activo y abierto de 24 semanas en pacientes con diabetes tipo 2 tratados previamente con insulina subcutánea (Estudio G)
| Estudio g | Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) |
|---|---|---|
| Tamaño de la muestra | 146 | 149 |
| UL = Humulina® U Ultralente®; SC R = insulina humana regular subcutánea | ||
| ||
| HbA1c (%) | ||
| Media basal | 8.1 | 8.2 |
| Adj. cambio medio desde el inicio | -0.7 | -0.6 |
| Exubera menos SC R* | -0.07 | |
| IC 95% para diferencia de tratamiento | (-0.31, 0.17) | |
| Glucosa en plasma en ayunas (mg / dL) | ||
| Media basal | 152 | 159 |
| Adj. cambio medio desde el inicio | -22 | -6 |
| Exubera menos SC R | -16.36 | |
| IC 95% para diferencia de tratamiento | (-27.09, -5.36) | |
| Pacientes con HbA al final del estudio1c < 8%†| 76.0% | 69.1% |
| Pacientes con HbA al final del estudio1c < 7% | 45.2% | 32.2% |
| Peso corporal | ||
| Media basal (kg) | 90.6 | 89.0 |
| Adj. cambio medio respecto al valor basal (kg) | 0.1 | 1.3 |
| Exubera menos SC R | -1.28 | |
| IC 95% para diferencia de tratamiento | (-1.96, -0.60) | |
| Fin de estudio dosis diaria de insulina | ||
| Insulina de acción corta | 16,6 mgC | 25,5 UI |
| Insulina de acción prolongada | 37,9 UI | 52,3 UI |
parte superior
Indicaciones y uso
Exubera está indicado para el tratamiento de pacientes adultos con diabetes mellitus para el control de la hiperglucemia. Exubera tiene un inicio de acción similar a los análogos de insulina de acción rápida y tiene una duración de la actividad reductora de glucosa comparable a la insulina humana regular administrada por vía subcutánea. En pacientes con diabetes tipo 1, Exubera debe usarse en regímenes que incluyen una insulina de acción más prolongada. En pacientes con diabetes tipo 2, Exubera puede usarse como monoterapia o en combinación con agentes orales o insulinas de acción prolongada.
parte superior
Contraindicaciones
Exubera está contraindicado en pacientes hipersensibles a Exubera o uno de sus excipientes.
Exubera está contraindicado en pacientes que fuman o que han dejado de fumar menos de 6 meses antes de comenzar la terapia con Exubera. Si un paciente comienza o vuelve a fumar, Exubera debe suspenderse inmediatamente debido al mayor riesgo de hipoglucemia, y debe utilizarse un tratamiento alternativo (ver FARMACOLOGÍA CLÍNICA, Poblaciones especiales, Tabaquismo). No se ha establecido la seguridad y eficacia de Exubera en pacientes que fuman.
Exubera está contraindicado en pacientes con enfermedad pulmonar inestable o mal controlada, debido a las grandes variaciones en la función pulmonar que podría afectar la absorción de Exubera y aumentar el riesgo de hipoglucemia o hiperglucemia
parte superior
Advertencias
Exubera se diferencia de la insulina humana regular por su rápido inicio de acción. Cuando se usa como insulina a la hora de las comidas, la dosis de Exubera debe administrarse dentro de los 10 minutos antes de una comida.
La hipoglucemia es el evento adverso más comúnmente reportado de la terapia con insulina, incluyendo Exubera. El momento de la hipoglucemia puede diferir entre varias formulaciones de insulina.
Los pacientes con diabetes tipo 1 también requieren una insulina de acción más prolongada para mantener un control adecuado de la glucosa.
Cualquier cambio de insulina debe hacerse con precaución y solo bajo supervisión médica. Los cambios en la intensidad de la insulina, el fabricante, el tipo (p. Ej., Regular, NPH, análogos) o la especie (animal, humano) pueden provocar la necesidad de un cambio en la dosis. Es posible que sea necesario ajustar el tratamiento antidiabético oral concomitante.
La monitorización de glucosa se recomienda para todos los pacientes con diabetes.
Debido al efecto de Exubera en la función pulmonar, se debe evaluar la función pulmonar de todos los pacientes antes de iniciar el tratamiento con Exubera (ver PRECAUCIONES: Función pulmonar).
No se recomienda el uso de Exubera en pacientes con enfermedad pulmonar subyacente, como asma o EPOC, porque no se ha establecido la seguridad y eficacia de Exubera en esta población (ver PRECAUCIONES: Enfermedad Pulmonar Subyacente).
En los ensayos clínicos de Exubera, ha habido 6 casos recién diagnosticados de neoplasias pulmonares primarias entre los pacientes tratados con Exubera, y 1 caso recién diagnosticado entre los pacientes tratados con comparador. También ha habido 1 informe posterior a la comercialización de una neoplasia pulmonar primaria en un paciente tratado con Exubera. En ensayos clínicos controlados de Exubera, la incidencia de cáncer de pulmón primario nuevo por 100 pacientes-años de exposición al fármaco en estudio fue de 0,13 (5 casos de más de 3900 años-paciente) para pacientes tratados con Exubera y 0,02 (1 caso de más de 4100 años-paciente) para pacientes tratados con comparador. Hubo muy pocos casos para determinar si la aparición de estos eventos está relacionada con Exubera. Todos los pacientes diagnosticados con cáncer de pulmón tenían antecedentes de tabaquismo.
parte superior
Precauciones
General
Al igual que con todas las preparaciones de insulina, el curso temporal de la acción de Exubera puede variar en diferentes individuos o en diferentes momentos en el mismo individuo. Puede ser necesario ajustar la dosis de cualquier insulina si los pacientes cambian su actividad física o su plan de comidas habitual. Los requisitos de insulina pueden alterarse durante condiciones intercurrentes como enfermedades, trastornos emocionales o estrés.
Hipoglucemia
Como con todas las preparaciones de insulina, las reacciones hipoglucémicas pueden estar asociadas con la administración de Exubera. Los cambios rápidos en las concentraciones de glucosa en suero pueden inducir síntomas similares a la hipoglucemia en personas con diabetes, independientemente del valor de glucosa. Los síntomas de advertencia temprana de hipoglucemia pueden ser diferentes o menos pronunciados bajo ciertas condiciones, como por ejemplo duración de la diabetes, enfermedad del nervio diabético, uso de medicamentos como betabloqueantes o control intensificado de la diabetes (ver PRECAUCIONES: Interacciones con la drogas). Tales situaciones pueden resultar en hipoglucemia severa (y, posiblemente, pérdida de conciencia) antes de que los pacientes estén conscientes de la hipoglucemia.
Insuficiencia renal
No se han realizado estudios en pacientes con insuficiencia renal. Al igual que con otras preparaciones de insulina, los requisitos de dosis de Exubera pueden reducirse en pacientes con insuficiencia renal (ver FARMACOLOGÍA CLÍNICA, Poblaciones especiales).
Deterioro hepático
No se han realizado estudios en pacientes con insuficiencia hepática. Al igual que con otras preparaciones de insulina, los requisitos de dosis de Exubera pueden reducirse en pacientes con insuficiencia hepática (ver FARMACOLOGÍA CLÍNICA, Poblaciones especiales).
Alergia
Alergia Sistémica
En estudios clínicos, la incidencia general de reacciones alérgicas en pacientes tratados con Exubera fue similar a la de pacientes que usan regímenes subcutáneos con insulina humana regular.
Al igual que con otras preparaciones de insulina, puede producirse una alergia generalizada a la insulina, rara pero potencialmente grave, que puede causar erupción (incluyendo prurito) en todo el cuerpo, falta de aliento, sibilancias, reducción de la presión arterial, pulso rápido o transpiración. Los casos graves de alergia generalizada, incluidas las reacciones anafilácticas, pueden ser potencialmente mortales. Si tales reacciones ocurren por Exubera, Exubera debe suspenderse y considerar terapias alternativas.
Producción de anticuerpos
Se pueden desarrollar anticuerpos contra la insulina durante el tratamiento con todas las preparaciones de insulina, incluida Exubera. En estudios clínicos de Exubera donde el comparador era insulina subcutánea, los aumentos en los niveles de anticuerpos de insulina (como lo reflejan los ensayos de actividad de unión a la insulina) fueron significativamente mayores para los pacientes que recibieron Exubera que para los pacientes que recibieron insulina subcutánea solamente. No se identificaron consecuencias clínicas de estos anticuerpos durante el período de tiempo de los estudios clínicos de Exubera; sin embargo, se desconoce la importancia clínica a largo plazo de este aumento en la formación de anticuerpos.
Respiratorio
Función pulmonar
En ensayos clínicos de hasta dos años de duración, los pacientes tratados con Exubera demostraron una mayor disminución en la función pulmonar, específicamente el volumen espiratorio forzado en un segundo (FEV1) y la capacidad de difusión de monóxido de carbono (DLCO), que el tratamiento comparado pacientes La diferencia media del grupo de tratamiento en la función pulmonar que favorece al grupo de comparación se observó dentro de las primeras semanas de tratamiento con Exubera, y no cambió durante el período de tratamiento de dos años (Ver REACCIONES ADVERSAS: Función pulmonar).
Durante los ensayos clínicos controlados, pacientes individuales experimentaron disminuciones notables en la función pulmonar en ambos grupos de tratamiento. Una disminución del FEV1 basal de â â ¥ 20% en la última observación ocurrió en el 1.5% de los pacientes tratados con Exubera y el 1.3% de los pacientes tratados con comparador. Una disminución desde la línea de base DLCO de 20 ¥ 20% en la última observación ocurrió en el 5,1% de los pacientes tratados con Exubera y el 3,6% de los pacientes tratados con comparador.
Debido al efecto de Exubera en la función pulmonar, todos los pacientes deben tener una espirometría (FEV1) evaluada antes de iniciar la terapia con Exubera. Valoración de DLCO debería ser considerado. La eficacia y seguridad de Exubera en pacientes con FEV basal1 o DLCO No se ha establecido <70% de lo previsto y no se recomienda el uso de Exubera en esta población.
Se recomienda la evaluación de la función pulmonar (p. Ej., Espirometría) después de los primeros 6 meses de tratamiento, y anualmente a partir de entonces, incluso en ausencia de síntomas pulmonares. En pacientes que tienen una disminución de ‰ ¥ 20% en FEV1 desde el inicio, se deben repetir las pruebas de función pulmonar. Si se confirma la disminución de â ‰ ¥ 20% desde el FEV1 basal, Exubera debe suspenderse. La presencia de síntomas pulmonares y disminuciones menores en la función pulmonar pueden requerir un monitoreo más frecuente de la función pulmonar y considerar la interrupción de Exubera.
Enfermedad Pulmonar Subyacente
No se recomienda el uso de Exubera en pacientes con enfermedad pulmonar subyacente, como asma o EPOC, porque no se ha establecido la eficacia y seguridad de Exubera en esta población.
Broncoespasmo
Raramente se ha informado broncoespasmo en pacientes que toman Exubera. Los pacientes que experimentan tal reacción deben suspender Exubera y buscar una evaluación médica de inmediato. La readministración de Exubera requiere una evaluación cuidadosa del riesgo, y solo debe realizarse bajo estrecha supervisión médica con las instalaciones clínicas adecuadas disponibles.
Enfermedad respiratoria intercurrente
Exubera se ha administrado a pacientes con enfermedades respiratorias intercurrentes (por ejemplo, bronquitis, infecciones del tracto respiratorio superior, rinitis) durante los estudios clínicos. En pacientes que experimentan estas afecciones, el 3-4% suspendió temporalmente la terapia con Exubera. No hubo un mayor riesgo de hipoglucemia o un peor control glucémico observado en pacientes tratados con Exubera en comparación con los pacientes tratados con insulina subcutánea. Durante la enfermedad respiratoria intercurrente, puede ser necesario un control estrecho de las concentraciones de glucosa en sangre y un ajuste de dosis.
Información para pacientes
Los pacientes deben recibir instrucciones sobre los procedimientos de autogestión, incluida la monitorización de glucosa; técnica de inhalación Exubera adecuada; e hipoglucemia e hiperglucemia. Se debe instruir a los pacientes sobre el manejo de situaciones especiales como condiciones intercurrentes (enfermedad, estrés o trastornos emocionales). trastornos), una dosis de insulina inadecuada u omitida, administración inadvertida de una dosis aumentada de insulina, ingesta inadecuada de alimentos o comidas omitidas
Se debe informar a los pacientes que en los estudios clínicos, el tratamiento con Exubera se asoció con pequeñas disminuciones medias no progresivas de la función pulmonar en relación con los tratamientos de comparación. Debido al efecto de Exubera en la función pulmonar, se recomiendan pruebas de función pulmonar antes de iniciar el tratamiento con Exubera. Después del inicio de la terapia, se recomiendan pruebas periódicas de la función pulmonar (ver PRECAUCIONES Función respiratoria, pulmonar).
Los pacientes deben informar a su médico si tienen antecedentes de enfermedad pulmonar, porque no se recomienda el uso de Exubera en pacientes con enfermedad pulmonar subyacente (p. ej., asma o EPOC) y está contraindicada en pacientes con pulmón mal controlado enfermedad.
Se debe aconsejar a las mujeres con diabetes que informen a su médico si están embarazadas o si están contemplando un embarazo.
parte superior
Interacciones con la drogas
Varias sustancias afectan el metabolismo de la glucosa y pueden requerir un ajuste de la dosis de insulina y, en particular, una estrecha vigilancia.
Los siguientes son ejemplos de sustancias que pueden reducir el efecto hipoglucemiante de la insulina que puede provocar hiperglucemia: corticosteroides, danazol, diazóxido, diuréticos, agentes simpaticomiméticos (por ejemplo, epinefrina, albuterol, terbutalina), glucagón, isoniazida, derivados de fenotiazina, somatropina, hormonas tiroideas, estrógenos, progestágenos (p. ej., en anticonceptivos orales), inhibidores de la proteasa y medicamentos antipsicóticos atípicos (p. ej., olanzapina y clozapina).
Los siguientes son ejemplos de sustancias que pueden aumentar el efecto hipoglucemiante de la insulina y la susceptibilidad a la hipoglucemia: oral productos antidiabéticos, inhibidores de la ECA, disopiramida, fibratos, fluoxetina, inhibidores de la MAO, pentoxifilina, propoxifeno, salicilatos y sulfonamida antibióticos
Los betabloqueantes, la clonidina, las sales de litio y el alcohol pueden aumentar o reducir el efecto hipoglucemiante de la insulina. La pentamidina puede causar hipoglucemia, que a veces puede ser seguida de hiperglucemia.
Además, bajo la influencia de medicamentos simpaticolíticos como los betabloqueantes, la clonidina, la guanetidina y la reserpina, los signos y síntomas de la hipoglucemia pueden verse reducidos o ausentes.
Los broncodilatadores y otros productos inhalados pueden alterar la absorción de la insulina humana inhalada (ver FARMACOLOGÍA CLÍNICA, Poblaciones especiales). Se recomienda un tiempo constante de dosificación de broncodilatadores en relación con la administración de Exubera, un control estrecho de las concentraciones de glucosa en sangre y la titulación de la dosis, según corresponda.
Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios de carcinogenicidad de dos años en animales. La insulina no fue mutagénica en la prueba de mutación inversa bacteriana de Ames en presencia y ausencia de activación metabólica.
En ratas Sprague-Dawley, se realizó un estudio de toxicidad de dosis repetidas de 6 meses con polvo de inhalación de insulina a dosis de hasta 5,8 mg / kg / día (en comparación con el clínico dosis inicial de 0.15 mg / kg / día, la dosis alta de rata fue 39 veces o 8.3 veces la dosis clínica, en base a una comparación de área de superficie corporal de mg / kg o mg / m2). En los monos Cynomolgus, se realizó un estudio de toxicidad de dosis repetidas de 6 meses con insulina inhalada a dosis de hasta 0,64 mg / kg / día. En comparación con la dosis clínica inicial de 0,15 mg / kg / día, la dosis alta de mono fue 4,3 veces o 1,4 veces la dosis clínica, basada en una comparación de área de superficie corporal de mg / kg o mg / m2. Estas fueron dosis máximas toleradas basadas en hipoglucemia.
En comparación con los animales de control, no hubo efectos adversos relacionados con el tratamiento en ninguna de las especies sobre la función pulmonar, la morfología macroscópica o microscópica del tracto respiratorio o los ganglios linfáticos bronquiales. Del mismo modo, no hubo efecto sobre los índices de proliferación celular en el área alveolar o bronquiolar del pulmón en ninguna de las especies.
Debido a que la insulina humana recombinante es idéntica a la hormona endógena, no se realizaron estudios de reproducción / fertilidad en animales.
El embarazo
Efectos teratogénicos
Embarazo Categoría C
No se han realizado estudios de reproducción animal con Exubera. Tampoco se sabe si Exubera puede causar daño fetal cuando se administra a una mujer embarazada o si Exubera puede afectar la capacidad reproductiva. Exubera debe administrarse a una mujer embarazada solo si es claramente necesario.
Madres lactantes
Muchas drogas, incluida la insulina humana, se excretan en la leche humana. Por esta razón, se debe tener precaución cuando Exubera se administra a una mujer lactante. Los pacientes con diabetes que están en período de lactancia pueden requerir ajustes en la dosis de Exubera, el plan de comidas o ambos.
Uso pediátrico
No se ha establecido la seguridad y eficacia a largo plazo de Exubera en pacientes pediátricos (ver FARMACOLOGÍA CLÍNICA, Poblaciones especiales).
Uso geriátrico
En estudios clínicos controlados de Fase 2/3 (n = 1975), Exubera se administró a 266 pacientes de 65 años de edad y 30 pacientes de 75 años de edad. La mayoría de estos pacientes tenían diabetes tipo 2. El cambio en HbA1C y la tasa de hipoglucemia no difirió según la edad.
parte superior
Reacciones adversas
La seguridad de Exubera sola, o en combinación con insulina subcutánea o agentes orales, ha sido evaluado en aproximadamente 2500 pacientes adultos con diabetes tipo 1 o tipo 2 que estuvieron expuestos a Exubera Aproximadamente 2000 pacientes estuvieron expuestos a Exubera durante más de 6 meses y más de 800 pacientes estuvieron expuestos durante más de 2 años.
Eventos adversos no respiratorios
Los eventos adversos no respiratorios informados en â ‰ ¥ 1% de los pacientes tratados con Exubera en 1977 en estudios clínicos controlados de Fase 2/3, independientemente de la causalidad, incluyen (pero no se limitan a) lo siguiente:
Metabólico y nutricional: hipoglucemia (ver Advertencias y PRECAUCIONES)
Cuerpo en general: dolor en el pecho
Digestivo: boca seca.
Sentidos especiales: otitis media (diabéticos pediátricos tipo 1)
Hipoglucemia
Las tasas e incidencia de hipoglucemia fueron comparables entre Exubera y la insulina humana regular subcutánea en pacientes con diabetes tipo 1 y tipo 2. En pacientes con tipo 2 que no fueron controlados adecuadamente con terapia de agente oral único, la adición de Exubera se asoció con una mayor tasa de hipoglucemia que la adición de un segundo oral agente.
Dolor de pecho
Una variedad de diferentes síntomas en el pecho se informaron como reacciones adversas y se agruparon bajo el término no específico dolor en el pecho. Estos eventos ocurrieron en el 4.7% de los pacientes tratados con Exubera y el 3.2% de los pacientes en los grupos de comparación. La mayoría (> 90%) de estos eventos se informaron como leves o moderados. Dos pacientes en el grupo Exubera y uno en el grupo de comparación interrumpieron el tratamiento debido a dolor en el pecho. La incidencia de eventos adversos de todas las causalidades relacionados con la enfermedad de la arteria coronaria, como la angina de pecho o el infarto de miocardio fue comparable en la Exubera (0,7% de angina de pecho; 0.7% de infarto de miocardio) y comparador (1.3% de angina de pecho; 0.7% infarto de miocardio) grupos de tratamiento.
Boca seca
Se notificó sequedad de boca en el 2,4% de los pacientes tratados con Exubera y en el 0,8% de los pacientes en los grupos de comparación. Casi todo (> 98%) de la boca seca informada fue leve o moderada. Ningún paciente interrumpió el tratamiento debido a sequedad de boca.
Eventos del oído en diabéticos pediátricos
Los diabéticos pediátricos tipo 1 en los grupos de Exubera experimentaron eventos adversos relacionados con el oído con mayor frecuencia que los diabéticos pediátricos tipo 1 en los grupos de tratamiento que recibieron solo insulina subcutánea. Estos eventos incluyeron otitis media (Exubera 6.5%; SC 3.4%), dolor de oído (Exubera 3.9%; SC 1.4%) y trastorno del oído (Exubera 1.3%; SC 0%).
Eventos adversos respiratorios
La Tabla 6 muestra la incidencia de eventos adversos respiratorios para cada grupo de tratamiento que se informaron en â ‰ ¥ 1% de cualquier grupo de tratamiento en estudios clínicos controlados de Fase 2 y 3, independientemente de la causalidad.
Tabla 6: Eventos adversos respiratorios notificados en â ‰ ¥ 1% de cualquier grupo de tratamiento en estudios clínicos controlados de fase 2 y 3, independientemente de la causalidad
| Porcentaje de pacientes que informan sobre un evento | |||||
|---|---|---|---|---|---|
| Acontecimiento adverso | Diabetes tipo 1 | Diabetes tipo 2 | |||
| Exubera N = 698 |
CAROLINA DEL SUR N = 705 |
Exubera N = 1279 |
CAROLINA DEL SUR N = 488 |
OAs N = 644 |
|
| SC = comparador de insulina subcutánea; OA = comparadores de agentes orales | |||||
| Infección del tracto respiratorio | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Tos aumentada | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| Faringitis | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| Rinitis | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| Sinusitis | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Desorden respiratorio | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| Disnea | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Esputo aumentado | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| Bronquitis | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| Asma | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| Epistaxis | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| Laringitis | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| Neumonía | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Alteración de voz | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
Tos
En 3 estudios clínicos, los pacientes que completaron un cuestionario sobre la tos informaron que la tos tendía a ocurrir dentro de segundos a minutos después de la inhalación de Exubera, fue predominantemente de gravedad leve y rara vez fue productiva en naturaleza. La incidencia de esta tos disminuyó con el uso continuo de Exubera. En estudios clínicos controlados, el 1.2% de los pacientes interrumpieron el tratamiento con Exubera debido a la tos.
Disnea
Casi toda la disnea (> 97%) se informó como leve o moderada. Un pequeño número de pacientes tratados con Exubera (0,4%) interrumpieron el tratamiento debido a la disnea en comparación con el 0,1% de los pacientes tratados con comparador.
Otros eventos adversos respiratorios: faringitis, aumento del esputo y epistaxis
La mayoría de estos eventos se informaron como leves o moderados. Un pequeño número de pacientes tratados con Exubera interrumpieron el tratamiento debido a faringitis (0.2%) y aumento del esputo (0.1%); Ningún paciente interrumpió el tratamiento debido a la epistaxis.
Función pulmonar
El efecto de Exubera en el sistema respiratorio se ha evaluado en más de 3800 pacientes en estudios clínicos controlados de fase 2 y 3 (en los cuales 1977 pacientes fueron tratados con Exubera). En ensayos clínicos aleatorizados, abiertos, de hasta dos años de duración, pacientes tratados con Exubera demostró una mayor disminución en la función pulmonar, específicamente el volumen espiratorio forzado en uno segundo (FEV1) y la capacidad de difusión de monóxido de carbono (DLCO), que los pacientes tratados con comparador. Las diferencias medias del grupo de tratamiento en el FEV1 y DLCO, se observaron dentro de las primeras semanas de tratamiento con Exubera, y no progresaron durante el período de tratamiento de dos años. En un ensayo clínico controlado completo en pacientes con diabetes tipo 2 después de dos años de tratamiento con Exubera, los pacientes mostraron resolución de la diferencia del grupo de tratamiento en el FEV1 seis semanas después de la interrupción de la terapia. La resolución del efecto de Exubera sobre la función pulmonar en pacientes con diabetes tipo 1 no se ha estudiado después del tratamiento a largo plazo.
Las figuras 3 a 6 muestran el VEF medio1 y DLCO cambio desde el inicio versus el tiempo de dos estudios aleatorizados, abiertos, de dos años en curso en 580 pacientes con diabetes tipo 1 y 620 pacientes con diabetes tipo 2.
Figura 3: Cambio desde el FEV1 (L) basal en pacientes con diabetes tipo 1 (media +/- desviación estándar)

Figura 4: Cambio desde el FEV1 (L) basal en pacientes con diabetes tipo 2 (media +/- desviación estándar)
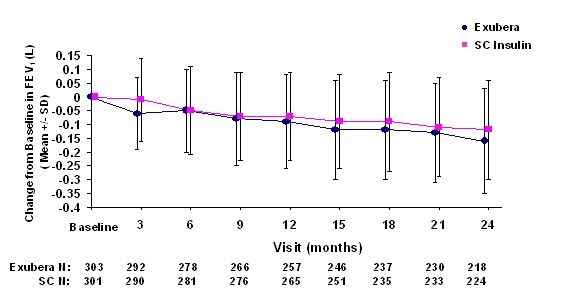
Después de 2 años de tratamiento con Exubera en pacientes con diabetes tipo 1 y tipo 2, la diferencia entre los grupos de tratamiento para el cambio medio desde el FEV1 basal fue de aproximadamente 40 ml, favoreciendo la comparador
Figura 5: Cambio desde la DLco basal (ml / min / mmHg) en pacientes con diabetes tipo 1 (media +/- desviación estándar)
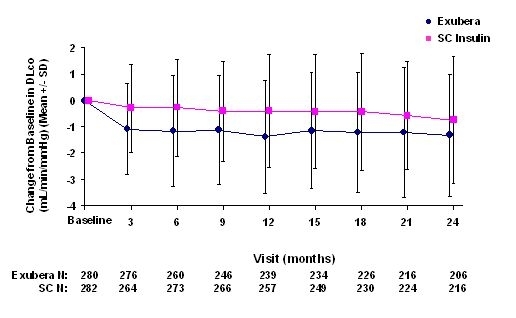
Figura 6: Cambio desde la DLco basal (ml / min / mmHg) en pacientes con diabetes tipo 2 (media +/- desviación estándar)

Después de 2 años de tratamiento con Exubera, la diferencia entre los grupos de tratamiento para el cambio medio del valor inicial DLCO fue de aproximadamente 0.5 ml / min / mmHg (diabetes tipo 1), a favor del comparador, y aproximadamente 0.1 ml / min / mmHg (diabetes tipo 2), a favor de Exubera.
Durante los ensayos clínicos de dos años, pacientes individuales experimentaron disminuciones notables en la función pulmonar en ambos grupos de tratamiento. Una disminución desde el FEV basal1 de 20 ¥ 20% en la última observación ocurrió en el 1.5% de los pacientes tratados con Exubera y el 1.3% de los pacientes tratados con comparador. Una disminución desde la línea de base DLCO de 20 ¥ 20% en la última observación ocurrió en el 5,1% de los pacientes tratados con Exubera y el 3,6% de los pacientes tratados con comparador.
parte superior
Sobredosis
La hipoglucemia puede ocurrir como resultado de un exceso de insulina en relación con la ingesta de alimentos, el gasto de energía o ambos.
Los episodios leves a moderados de hipoglucemia generalmente se pueden tratar con glucosa oral. Es posible que se necesiten ajustes en la dosis del medicamento, los patrones de comida o el ejercicio.
Los episodios severos de hipoglucemia con coma, convulsiones o deterioro neurológico pueden tratarse con glucagón intramuscular / subcutáneo o glucosa intravenosa concentrada. La ingesta sostenida de carbohidratos y la observación pueden ser necesarias porque la hipoglucemia puede reaparecer después de una recuperación clínica aparente.
parte superior
Dosificación y administración
Exubera, como los análogos de insulina de acción rápida, tiene un inicio más rápido de actividad reductora de glucosa en comparación con la insulina humana regular inyectada por vía subcutánea. Exubera tiene una duración de actividad reductora de glucosa comparable a la insulina humana regular inyectada por vía subcutánea y más larga que la insulina de acción rápida. Las dosis de Exubera se deben administrar inmediatamente antes de las comidas (no más de 10 minutos antes de cada comida).
En pacientes con diabetes tipo 1, Exubera debe usarse en regímenes que incluyen una insulina de acción más prolongada. Para pacientes con diabetes tipo 2, Exubera puede usarse como monoterapia o en combinación con agentes orales o insulina de acción prolongada.
Debido al efecto de Exubera en la función pulmonar, se debe evaluar la función pulmonar de todos los pacientes antes de iniciar el tratamiento con Exubera. Se recomienda la monitorización periódica de la función pulmonar en pacientes tratados con Exubera (ver PRECAUCIONES, Función pulmonar).
Exubera está destinado a la administración por inhalación y solo debe administrarse utilizando Exubera® Inhalador. Referirse a Guía de medicamentos de Exubera para una descripción de la Exubera® Inhalador y para obtener instrucciones sobre cómo usar el inhalador.
Cálculo de la dosis inicial de exubera previa a la comida
La dosis inicial de Exubera se debe individualizar y determinar según los consejos del médico de acuerdo con las necesidades del paciente. Las dosis iniciales recomendadas antes de las comidas se basan en ensayos clínicos en los que se solicitó a los pacientes que comieran tres comidas al día. Las dosis iniciales antes de las comidas se pueden calcular utilizando la siguiente fórmula: [Peso corporal (kg) X 0.05 mg / kg = dosis antes de las comidas (mg)] redondeado al número de miligramo entero más cercano (por ejemplo, 3.7 mg redondeado a 3 mg).
Las pautas aproximadas para las dosis iniciales de Exubera antes de las comidas, basadas en el peso corporal del paciente, se indican en la Tabla 7:
Tabla 7: Pautas aproximadas para la dosis inicial de exubera previa a la comida (según el peso corporal del paciente)
| Peso del paciente (en kg) |
Peso del paciente (en libras) |
Dosis inicial por comida | Número de ampollas de 1 mg por dosis | Número de ampollas de 3 mg por dosis |
|---|---|---|---|---|
| 30 a 39,9 kg | 66 - 87 libras | 1 mg por comida | 1 | - |
| 40 a 59,9 kg | 88 - 132 libras | 2 mg por comida | 2 | - |
| 60 a 79,9 kg | 133 - 176 lb | 3 mg por comida | - | 1 |
| 80 a 99,9 kg | 177 - 220 libras | 4 mg por comida | 1 | 1 |
| 100 a 119,9 kg | 221-264 lb | 5 mg por comida | 2 | 1 |
| 120 a 139,9 kg | 265 - 308 libras | 6 mg por comida | - | 2 |
Una ampolla de 1 mg de insulina inhalada Exubera es aproximadamente equivalente a 3 UI de insulina humana regular inyectada por vía subcutánea. Una ampolla de 3 mg de insulina inhalada Exubera es aproximadamente equivalente a 8 UI de insulina humana regular inyectada por vía subcutánea. La Tabla 8 proporciona la dosis aproximada de UI de insulina humana subcutánea regular para las dosis de insulina inhalada Exubera de 1 mg a 6 mg.
Tabla 8: Dosis aproximada de UI equivalente de insulina subcutánea humana regular para las dosis de insulina inhalada Exubera que van de 1 mg a 6 mg
| Dosis (mg) | Dosis regular aproximada de insulina SC en UI | Número de ampollas de Exubera de 1 mg por dosis | Número de ampollas de Exubera de 3 mg por dosis |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Los pacientes deben combinar ampollas de 1 mg y 3 mg para que se tome el menor número de ampollas por dosis (por ejemplo, se debe administrar una dosis de 4 mg como una ampolla de 1 mg y una ampolla de 3 mg). La inhalación consecutiva de tres ampollas de dosis unitaria de 1 mg da como resultado una exposición a la insulina significativamente mayor que la inhalación de una ampolla de dosis unitaria de 3 mg. Por lo tanto, tres dosis de 1 mg no deben sustituirse por una dosis de 3 mg (ver FARMACOLOGÍA CLÍNICA, Farmacocinética). Cuando un paciente se estabiliza con un régimen de dosificación que incluye ampollas de 3 mg y ampollas de 3 mg no está disponible temporalmente, el paciente puede sustituir temporalmente dos ampollas de 1 mg por una de 3 mg ampolla. La glucosa en sangre debe controlarse de cerca.
Como con todas las insulinas, los factores adicionales que deben tenerse en cuenta al determinar la dosis inicial de Exubera incluyen, pero no se limitan al control glucémico actual del paciente, la respuesta previa a la insulina, la duración de la diabetes y la dieta y el ejercicio Hábitos
Consideraciones para la titulación de dosis
Después de iniciar la terapia con Exubera, como con otros agentes reductores de la glucosa, puede ser necesario un ajuste de la dosis en función de necesidad del paciente (p. ej., concentraciones de glucosa en sangre, tamaño de comida y composición de nutrientes, hora del día y reciente o anticipada ejercicio). Cada paciente debe ajustarse a su dosis óptima en función de los resultados de la monitorización de glucosa en sangre.
Como para todas las insulinas, el curso temporal de la acción de Exubera puede variar en diferentes individuos o en diferentes momentos en el mismo individuo.
Exubera puede usarse durante enfermedades respiratorias intercurrentes (por ejemplo, bronquitis, infección del tracto respiratorio superior, rinitis). Es posible que se requiera un control estrecho de las concentraciones de glucosa en sangre y un ajuste de dosis de forma individual. Los medicamentos inhalados (por ejemplo, broncodilatadores) deben administrarse antes de la administración de Exubera.
parte superior
Cómo suministrado
El polvo de inhalación de Exubera (insulina humana [ADNr]) está disponible en blísteres de dosis unitaria de 1 mg y 3 mg. Las ampollas se dispensan en tarjetas perforadas de seis ampollas de dosis unitarias (PVC / aluminio). Las dos fortalezas se diferencian por la impresión en color y las marcas táctiles que se pueden diferenciar por el tacto. Las ampollas de 1 mg y las tarjetas perforadas respectivas se imprimen con tinta verde y las tarjetas se marcan con una barra en relieve. Las ampollas de 3 mg y las tarjetas perforadas respectivas se imprimen con tinta azul y las tarjetas se marcan con tres barras en relieve.
Se empaquetan cinco tarjetas blíster en una bandeja termoformada de plástico transparente (PET). Cada bandeja de PET también contiene un desecante y está cubierta con una tapa de plástico transparente (PET). La bandeja de cinco tarjetas blister (30 blísteres de dosis unitarias) está sellada en una bolsa laminada de aluminio con un desecante.
Exubera (insulina humana [origen de ADNr]) ampollas de inhalación en polvo, una Exubera® Inhalador y reemplazo Exubera® Las unidades de liberación son necesarias para iniciar la terapia con Exubera y se proporcionan en el kit Exubera. Una Exubera completamente ensamblada® El inhalador consiste en la base del inhalador, una cámara y una Exubera.® Unidad de liberación. Un inhalador completamente ensamblado se empaqueta con una cámara de reemplazo y está disponible en el kit Exubera y como una unidad separada. La cámara también está disponible como componente individual.
Exubera® Las unidades de liberación se empaquetan individualmente en una bandeja termoformada sellada. Una exubera® La unidad de liberación se incluye en cada inhalador completamente ensamblado. Se proporcionan dos unidades de liberación adicionales en el kit Exubera y en cada paquete combinado. Las unidades de liberación Exubera también están disponibles individualmente.
Consulte las Tablas 9 y 10 para obtener una descripción de estas configuraciones.
Tabla 9
| El polvo de inhalación de exubera (insulina humana [ADNr]) está disponible de la siguiente manera: | ||
|---|---|---|
| Descripción | Contenido | NDC |
| KIT EXUBERA | 1 inhalador Exubera 1 cámara de repuesto 1 mg - 180 ampollas 3 mg × 90 ampollas 2 Exubera® Unidades de liberación |
0069-0050-85 |
| Paquete Combinado Exubera 12 | 1 mg × 90 ampollas 3 mg × 90 ampollas 2 Exubera® Unidades de liberación |
0069-0050-19 |
| Paquete Combinado Exubera 15 | 1 mg - 180 ampollas 3 mg × 90 ampollas 2 Exubera® Unidades de liberación |
0069-0050-53 |
| Exubera 1 mg Paciente Pack | 90 × 1 mg 2 Exubera® Unidades de liberación |
0069-0707-37 |
| Exubera 3 mg Paciente Pack | 90 × 3 mg 2 Exubera® Unidades de liberación |
0069-0724-37 |
Tabla 10
| Exubera® El inhalador y los componentes están disponibles de la siguiente manera: | ||
|---|---|---|
| Descripción | Contenido | NDC |
| Exubera® Inhalador y cámara | 1 exubera® Inhalador 1 cámara de repuesto |
0069-0054-19 |
| Exubera® Unidades de liberación | 2 Exubera® Unidades de liberación | 0069-0097-41 |
| Exubera® Cámara | 1 cámara de repuesto | 0069-0061-19 |
Almacenamiento de la ampolla
No en uso (sin abrir): Almacenar a temperatura ambiente controlada, 25 ° C (77 ° F); excursiones permitidas a 15-30 ° C (59-86 ° F) [consulte Temperatura ambiente controlada de USP]. No congelar. No refrigerar
En uso: una vez que se abre la envoltura de aluminio, las ampollas de dosis unitarias deben protegerse de la humedad y almacenarse a 25 ° C (77 ° F); excursiones permitidas a 15-30 ° C (59-86 ° F) [consulte Temperatura ambiente controlada de USP]. No congelar. No refrigerar Las ampollas de dosis unitarias deben usarse dentro de los 3 meses posteriores a la apertura de la envoltura de aluminio. Regrese las ampollas a la envoltura para protegerla de la humedad. Se debe tener especial cuidado para evitar ambientes húmedos, p. Ej. baño de vapor después de una ducha.
Deseche la ampolla si está congelada.
Almacenamiento de inhaladores
Almacenar a temperatura ambiente controlada, 25 ° C (77 ° F); excursiones permitidas a 15-30 ° C (59-86 ° F) [consulte Temperatura ambiente controlada de USP]. No congelar. No refrigerar
La exubera® El inhalador se puede usar hasta por 1 año a partir de la fecha de primer uso.
Reemplazando La Exubera® Unidad de lanzamiento
La exubera® Unidad de Lanzamiento en la Exubera® El inhalador debe cambiarse cada 2 semanas.
Mantener fuera del alcance de los niños
Solo Rx

LAB-0331-12.0
última revisión 04/2008
Exubera, insulina humana [origen ADNr] Información para el paciente (en inglés simple)
Información detallada sobre signos, síntomas, causas, tratamientos de diabetes
La información de esta monografía no pretende abarcar todos los usos, instrucciones, precauciones, interacciones farmacológicas o efectos adversos posibles. Esta información es generalizada y no pretende ser un consejo médico específico. Si tiene preguntas sobre los medicamentos que está tomando o desea obtener más información, consulte con su médico, farmacéutico o enfermero.
de regreso: Ver todos los medicamentos para la diabetes



