Provigil: Tratamiento para la vigilia (Información de prescripción completa)
Nombre de la marca: Provigil
Nombre genérico: modafinilo
Contenido:
Descripción
Farmacología
Senderos clínicos
Indicaciones y uso
Contraindicaciones
Advertencias
Precauciones
Reacciones adversas
Abuso y dependencia de drogas
Sobredosis
Dosificación y administración
Cómo suministrado
Provigil (modafinil) hoja de información para el paciente (en inglés simple)
Descripción
Provigil (modafinilo) es un agente promotor de la vigilia para la administración oral. El modafinilo es un compuesto racémico. El nombre químico de modafinilo es 2 - [(difenilmetil) sulfinil] acetamida. La fórmula molecular es C15H15NO2S y el peso molecular es 273.35.
La estructura química es:
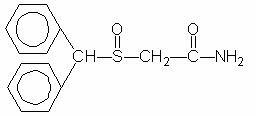
El modafinilo es un polvo cristalino blanco a blanquecino que es prácticamente insoluble en agua y ciclohexano. Es poco soluble en ligeramente soluble en metanol y acetona. Las tabletas de Provigil contienen 100 mg o 200 mg de modafinilo y los siguientes ingredientes inactivos: lactosa, celulosa microcristalina, almidón pregelatinizado, croscarmelosa sódica, povidona y magnesio estearato
parte superior
Farmacología Clínica
Mecanismo de acción y farmacología.
Se desconocen los mecanismos precisos a través de los cuales el modafinilo promueve la vigilia. El modafinilo tiene acciones de promoción de la estela similares a los agentes simpaticomiméticos como la anfetamina y el metilfenidato, aunque el perfil farmacológico no es idéntico al de las aminas simpaticomiméticas.
El modafinilo tiene interacciones débiles a insignificantes con los receptores de noradrenalina, serotonina, dopamina, GABA, adenosina, histamina-3, melatonina y benzodiacepinas. El modafinilo tampoco inhibe las actividades de MAO-B o fosfodiesterasas II-V.
La vigilia inducida por modafinilo puede ser atenuada por el antagonista del receptor adrenérgico α1 prazosina; sin embargo, el modafinilo está inactivo en otros sistemas de ensayo in vitro que se sabe que responden a los agonistas α-adrenérgicos, como la preparación deferente de la rata.
El modafinilo no es un agonista del receptor de dopamina de acción directa o indirecta. Sin embargo, in vitro, el modafinilo se une al transportador de dopamina e inhibe la recaptación de dopamina. Esta actividad se ha asociado in vivo con mayores niveles de dopamina extracelular en algunas regiones del cerebro de los animales. En ratones genéticamente modificados que carecían del transportador de dopamina (DAT), el modafinilo carecía de actividad promotora de la estela, lo que sugiere que esta actividad dependía de DAT. Sin embargo, los efectos que promueven la estela del modafinilo, a diferencia de los de la anfetamina, no fueron antagonizados por el antagonista del receptor de dopamina haloperidol en ratas. Además, la alfa-metil-p-tirosina, un inhibidor de la síntesis de dopamina, bloquea la acción de la anfetamina, pero no bloquea la actividad locomotora inducida por el modafinilo.
En el gato, dosis iguales de metilfenidato y anfetamina que promueven la vigilia aumentaron la activación neuronal en todo el cerebro. El modafinilo a una dosis equivalente que promueve la vigilia aumentó selectivamente y prominentemente la activación neuronal en regiones más discretas del cerebro. Se desconoce la relación de este hallazgo en gatos con los efectos del modafinilo en humanos.
Además de sus efectos que promueven la estela y su capacidad para aumentar la actividad locomotora en animales, el modafinilo produce Efectos psicoactivos y eufóricos, alteraciones en el estado de ánimo, la percepción, el pensamiento y los sentimientos típicos de otros estimulantes del SNC. Inhumanos. El modafinilo tiene propiedades de refuerzo, como lo demuestra su autoadministración en monos previamente entrenados para autoadministrarse cocaína. El modafinilo también fue parcialmente discriminado como estimulante.
Los enantiómeros ópticos de modafinilo tienen acciones farmacológicas similares en animales. Dos metabolitos principales del modafinilo, el ácido de modafinilo y la sulfona de modafinilo, no parecen contribuir a las propiedades activadoras del SNC del modafinilo.
Farmacocinética
El modafinilo es un compuesto racémico, cuyos enantiómeros tienen una farmacocinética diferente (por ejemplo, la vida media del isómero l es aproximadamente tres veces mayor que la del isómero d en humanos adultos). Los enantiómeros no se interconvierten. En estado estacionario, la exposición total al isómero l es aproximadamente tres veces mayor que la del isómero d. La concentración mínima (Cminss) de modafinilo circulante después de una dosificación diaria consiste en 90% del isómero l y 10% del isómero d. La vida media de eliminación efectiva de modafinilo después de múltiples dosis es de aproximadamente 15 horas. Los enantiómeros de modafinilo exhiben una cinética lineal con dosis múltiples de 200-600 mg / día una vez al día en voluntarios sanos. Los estados estacionarios aparentes de modafinilo total y l - (-) - modafinilo se alcanzan después de 2-4 días de dosificación.
Absorción
La absorción de las tabletas de Provigil es rápida, con concentraciones plasmáticas máximas a las 2-4 horas. La biodisponibilidad de las tabletas de Provigil es aproximadamente igual a la de una suspensión acuosa. La biodisponibilidad oral absoluta no se determinó debido a la insolubilidad acuosa (<1 mg / ml) de modafinilo, que impidió la administración intravenosa. Los alimentos no tienen ningún efecto sobre la biodisponibilidad general de Provigil; sin embargo, su absorción (tmax) puede retrasarse aproximadamente una hora si se toma con alimentos.
Distribución
El modafinilo está bien distribuido en el tejido corporal con un volumen aparente de distribución (~ 0.9 L / kg) mayor que el volumen de agua corporal total (0.6 L / kg). En plasma humano, in vitro, el modafinilo se une moderadamente a las proteínas plasmáticas (~ 60%, principalmente a la albúmina). A las concentraciones séricas obtenidas en estado estacionario después de dosis de 200 mg / día, el modafinilo no muestra desplazamiento de la unión a proteínas de warfarina, diazepam o propranolol. Incluso a concentraciones mucho mayores (1000 µM; > 25 veces la Cmax de 40 µM en estado estacionario a 400 mg / día), el modafinilo no tiene efecto sobre la unión de warfarina. El ácido modafinilo a concentraciones> 500 µM disminuye la extensión de la unión a warfarina, pero estas concentraciones son> 35 veces las alcanzadas terapéuticamente.
Metabolismo y Eliminación
La ruta principal de eliminación es el metabolismo (~ 90%), principalmente por el hígado, con la posterior eliminación renal de los metabolitos. La alcalinización de la orina no tiene efecto sobre la eliminación de modafinilo.
El metabolismo ocurre a través de la desamidación hidrolítica, la oxidación S, la hidroxilación de anillos aromáticos y la conjugación de glucurónidos. Menos del 10% de una dosis administrada se excreta como el compuesto original. En un estudio clínico con modafinilo radiomarcado, un total de 81% de la radiactividad administrada se recuperó en 11 días después de la dosis, predominantemente en la orina (80% vs. 1.0% en las heces). La fracción más grande de la droga en la orina fue el ácido modafinilo, pero al menos otros seis metabolitos estaban presentes en concentraciones más bajas. Solo dos metabolitos alcanzan concentraciones apreciables en plasma, es decir, ácido modafinilo y sulfona modafinilo. En modelos preclínicos, el ácido modafinilo, la modafinil sulfona, el ácido 2 - [(difenilmetil) sulfonil] acético y el 4-hidroxi modafinilo, estaban inactivos o no parecían mediar los efectos de excitación del modafinilo.
En adultos, a veces se han observado disminuciones en los niveles mínimos de modafinilo después de varias semanas de dosificación, lo que sugiere autoinducción, pero la magnitud de las disminuciones y la inconsistencia de su aparición sugieren que su importancia clínica es mínimo Se ha observado una acumulación significativa de modafinil sulfona después de múltiples dosis debido a su larga vida media de eliminación de 40 horas. La inducción de enzimas metabolizantes, lo más importante del citocromo P-450 (CYP) 3A4, también se ha observado in vitro después de incubación de cultivos primarios de hepatocitos humanos con modafinilo e in vivo después de la administración prolongada de modafinilo en 400 mg / día. (Para más información sobre los efectos del modafinilo en las actividades de la enzima CYP, ver PRECAUCIONES, Interacciones con la drogas.)
Interacciones farmacológicas:
Según los datos in vitro, el modafinilo se metaboliza parcialmente por la subfamilia de isoformas 3A del citocromo hepático P450 (CYP3A4). Además, el modafinilo tiene el potencial de inhibir CYP2C19, suprimir CYP2C9 e inducir CYP3A4, CYP2B6 y CYP1A2. Debido a que modafinilo y modafinilo sulfona son inhibidores reversibles de la enzima metabolizadora de fármacos CYP2C19, la administración conjunta de modafinilo con medicamentos como el diazepam, la fenitoína y el propranolol, que se eliminan en gran medida por esa vía, pueden aumentar los niveles circulantes de esos compuestos. Además, en individuos deficientes en la enzima CYP2D6 (es decir, 7-10% de la población caucásica; similar o inferior en otras poblaciones), los niveles de sustratos de CYP2D6 como los antidepresivos tricíclicos y la serotonina selectiva los inhibidores de la recaptación, que tienen rutas auxiliares de eliminación a través de CYP2C19, pueden incrementarse mediante la administración conjunta de modafinilo Los ajustes de dosis pueden ser necesarios para los pacientes tratados con estos y otros medicamentos similares (ver PRECAUCIONES, Interacciones con la drogas). Un estudio in vitro demostró que el armodafinilo (uno de los enantiómeros del modafinilo) es un sustrato de la glicoproteína P.
La administración conjunta de modafinilo con otros fármacos activos del SNC como el metilfenidato y la dextroanfetamina no alteró significativamente la farmacocinética de ninguno de los fármacos.
Se encontró que la administración crónica de modafinilo 400 mg disminuye la exposición sistémica a dos CYP3A4 sustratos, etinilestradiol y triazolam, después de la administración oral, lo que sugiere que CYP3A4 había sido inducido. La administración crónica de modafinilo puede aumentar la eliminación de sustratos de CYP3A4. Los ajustes de dosis pueden ser necesarios para los pacientes tratados con estos y otros medicamentos similares (ver PRECAUCIONES, Interacciones con la drogas).
Se observó una aparente supresión relacionada con la concentración de la actividad de CYP2C9 en hepatocitos humanos después de la exposición a modafinilo in vitro sugiriendo que existe la posibilidad de una interacción metabólica entre el modafinilo y los sustratos de esta enzima (por ejemplo, S-warfarina, fenitoína). Sin embargo, en un estudio de interacción en voluntarios sanos, el tratamiento crónico con modafinilo no mostró un efecto significativo sobre la farmacocinética de la warfarina en comparación con el placebo. (Ver PRECAUCIONES, Interacciones farmacológicas, Otras drogas, Warfarina).
Poblaciones Especiales
Efecto de género:
La farmacocinética de modafinilo no se ve afectada por el género.
Efecto de edad:
Se observó una ligera disminución (~ 20%) en el aclaramiento oral (CL / F) de modafinilo en un estudio de dosis única a 200 mg en 12 sujetos con una edad media de 63 años (rango 53-72 años), pero no se consideró que el cambio fuera clínicamente significativo. En un estudio de dosis múltiples (300 mg / día) en 12 pacientes con una edad media de 82 años (rango 67-87 años), la media los niveles de modafinilo en plasma fueron aproximadamente dos veces mayores que los obtenidos históricamente en pacientes más jóvenes asignaturas. Debido a los posibles efectos de los múltiples medicamentos concomitantes con los que la mayoría de los pacientes estaban siendo tratada, la diferencia aparente en la farmacocinética de modafinilo puede no ser atribuible únicamente a los efectos de envejecimiento. Sin embargo, los resultados sugieren que el aclaramiento de modafinilo puede reducirse en los ancianos (Ver Dosificación y administración).
Efecto de raza:
La influencia de la raza en la farmacocinética de modafinilo no se ha estudiado.
Insuficiencia renal:
En un estudio de dosis única de 200 mg de modafinilo, la insuficiencia renal crónica grave (aclaramiento de creatinina â ‰ ¤ 20 ml / min) no influye significativamente en la farmacocinética de modafinilo, pero la exposición al ácido de modafinilo (un metabolito inactivo) aumentó 9 veces (Ver PRECAUCIONES).
Deterioro hepático:
La farmacocinética y el metabolismo se examinaron en pacientes con cirrosis hepática (6 hombres y 3 mujeres). Tres pacientes tenían cirrosis en estadio B o B + (según los criterios de Child) y 6 pacientes tenían cirrosis en estadio C o C +. Clínicamente 8 de 9 pacientes eran ictéricos y todos tenían ascitis. En estos pacientes, el aclaramiento oral de modafinilo se redujo en aproximadamente un 60% y la concentración en estado estacionario se duplicó en comparación con los pacientes normales. La dosis de Provigil debe reducirse en pacientes con insuficiencia hepática grave (ver PRECAUCIONES y Dosificación y administración).
parte superior
Senderos clínicos
La efectividad de Provigil para reducir la somnolencia excesiva se ha establecido en el sueño siguiente trastornos: narcolepsia, síndrome de apnea obstructiva del sueño / hipopnea (SAHS) y trastorno del sueño en el trabajo por turnos (SWSD)
Narcolepsia
La efectividad de Provigil para reducir la somnolencia excesiva (ES) asociada con la narcolepsia se estableció en dos EE. UU. De 9 semanas, estudios multicéntricos, controlados con placebo, de dos dosis (200 mg por día y 400 mg por día) de grupos paralelos, doble ciego, de pacientes ambulatorios que cumplieron con el Los criterios de la CIE-9 y la Asociación Estadounidense de Trastornos del Sueño para la narcolepsia (que también son consistentes con la Asociación Estadounidense de Psiquiatría) DSM-IV criterios). Estos criterios incluyen 1) siestas o lapsos recurrentes durante el día que ocurren casi a diario durante al menos tres meses, más pérdida bilateral repentina del tono muscular postural en asociación con emoción intensa (cataplejía) o 2) una queja de somnolencia excesiva o debilidad muscular repentina con características asociadas: parálisis del sueño, alucinaciones hipnagógicas, comportamientos automáticos, sueño mayor interrumpido episodio; y polisomnografía que demuestra uno de los siguientes: latencia del sueño inferior a 10 minutos o latencia del sueño de movimiento ocular rápido (REM) inferior a 20 minutos. Además, para ingresar a estos estudios, todos los pacientes debían haber documentado objetivamente la somnolencia diurna excesiva, un sueño múltiple Prueba de latencia (MSLT) con dos o más períodos REM de inicio del sueño y la ausencia de cualquier otro médico o psiquiátrico activo clínicamente significativo trastorno. El MSLT, una evaluación polisomnográfica objetiva diurna de la capacidad del paciente para conciliar el sueño de una manera no estimulante ambiente, mide la latencia (en minutos) para el inicio del sueño en promedio durante 4 sesiones de prueba a intervalos de 2 horas después de la noche polisomnografía. Para cada sesión de prueba, se le dijo al sujeto que se acostara en silencio e intentara dormir. Cada sesión de prueba se terminó después de 20 minutos si no se produjo el sueño o 15 minutos después del inicio del sueño.
En ambos estudios, las principales medidas de efectividad fueron 1) la latencia del sueño, según lo evaluado por la Prueba de mantenimiento de la vigilia (MWT) y 2) el cambio en el estado general de la enfermedad del paciente, medido por la Impresión clínica global de cambio (CGI-C). Para un ensayo exitoso, ambas medidas tuvieron que mostrar una mejora significativa.
El MWT mide la latencia (en minutos) para el inicio del sueño en promedio durante 4 sesiones de prueba a intervalos de 2 horas después de la polisomnografía nocturna. Para cada sesión de prueba, se le pidió al sujeto que intentara permanecer despierto sin usar medidas extraordinarias. Cada sesión de prueba se terminó después de 20 minutos si no se produjo el sueño o 10 minutos después del inicio del sueño. El CGI-C es una escala de 7 puntos, centrada en Sin cambios, y que va de Mucho peor a Muy mejorada. Los pacientes fueron evaluados por evaluadores que no tenían acceso a ningún dato sobre los pacientes que no fuera una medida de su gravedad inicial. Los evaluadores no recibieron ninguna orientación específica sobre los criterios que debían aplicar al calificar a los pacientes.
Otras evaluaciones del efecto incluyeron la Prueba de latencia del sueño múltiple (MSLT), la Escala de somnolencia de Epworth (ESS; una serie de preguntas diseñadas para evaluar el grado de somnolencia en situaciones cotidianas) el Steer Clear Performance Test (SCPT; una evaluación basada en computadora de la capacidad del paciente para evitar golpear obstáculos en una situación de conducción simulada), polisomnografía nocturna estándar y el registro diario de sueño del paciente. Los pacientes también fueron evaluados con la escala de calidad de vida en narcolepsia (QOLIN), que contiene el cuestionario de salud SF-36 validado.
Ambos estudios demostraron una mejora en las medidas objetivas y subjetivas de la somnolencia diurna excesiva para las dosis de 200 mg y 400 mg en comparación con el placebo. Los pacientes tratados con cualquiera de las dosis de Provigil mostraron una capacidad estadísticamente mejorada para permanecer despierto con el MWT (todos los valores de p <0.001) en semanas 3, 6, 9 y visita final en comparación con placebo y una mejora global estadísticamente significativamente mayor, según la escala de CGI-C (todos los valores de p <0.05).
Las latencias promedio de sueño (en minutos) en el MWT al inicio del estudio para los 2 ensayos controlados se muestran en la Tabla 1 a continuación, junto con el cambio promedio desde el inicio en el MWT en la visita final.
Los porcentajes de pacientes que mostraron algún grado de mejora en el CGI-C en los dos ensayos clínicos se muestran en la Tabla 2 a continuación.
Se observaron mejoras similares estadísticamente significativas relacionadas con el tratamiento en otras medidas de discapacidad en narcolepsia, incluido un paciente evaluado el nivel de somnolencia diurna en el ESS (p <0.001 para cada dosis en comparación con placebo).
El sueño nocturno medido con polisomnografía no se vio afectado por el uso de Provigil.
Síndrome de apnea obstructiva del sueño / hipopnea (SAHS)
La efectividad de Provigil para reducir la somnolencia excesiva asociada con el SAHS se estableció en dos ensayos clínicos. En ambos estudios, se incluyeron pacientes que cumplían con la Clasificación Internacional de Trastornos del Sueño (ICSD) criterios para OSAHS (que también son consistentes con la Asociación Americana de Psiquiatría DSM-IV criterios) Estos criterios incluyen: 1) somnolencia excesiva o insomnio, además de episodios frecuentes de discapacidad. respiración durante el sueño y características asociadas como ronquidos fuertes, dolores de cabeza matutinos y sequedad de boca despertar; o 2) somnolencia excesiva o insomnio y polisomnografía que demuestran uno de los siguientes: más de cinco apneas obstructivas, cada una de más de 10 segundos de duración, por hora del sueño y uno o más de los siguientes: excitaciones frecuentes del sueño asociadas con las apneas, bradicardia y desaturación arterial de oxígeno en asociación con apneas Además, para ingresar a estos estudios, todos los pacientes debían tener somnolencia excesiva como se demostró por un puntaje â ‰ ¥ 10 en la escala de somnolencia de Epworth, a pesar del tratamiento con presión positiva continua en las vías respiratorias (CPAP) Se requirió evidencia de que la CPAP fue efectiva para reducir los episodios de apnea / hipopnea junto con la documentación del uso de la CPAP.
En el primer estudio, un ensayo multicéntrico controlado con placebo de 12 semanas, un total de 327 pacientes fueron asignados al azar para recibir Provigil 200 mg / día, Provigil 400 mg / día o un placebo equivalente. La mayoría de los pacientes (80%) cumplían totalmente con CPAP, definido como uso de CPAP> 4 horas / noche en> 70% noches. El resto cumplió parcialmente con CPAP, definido como uso de CPAP 30% noches. El uso de CPAP continuó durante todo el estudio. Las principales medidas de efectividad fueron 1) latencia del sueño, según lo evaluado por la Prueba de mantenimiento de la vigilia (MWT) y 2) cambio en el estado general de la enfermedad del paciente, medido por la Impresión clínica global de cambio (CGI-C) en la semana 12 o la final visitar. (Ver Senderos clínicos, Sección de narcolepsia anterior para obtener una descripción de estas pruebas).
Los pacientes tratados con Provigil mostraron una mejora estadísticamente significativa en la capacidad de permanecer despierto en comparación con los pacientes tratados con placebo medido por el MWT (p <0.001) en el punto final [Tabla 1]. Los pacientes tratados con Provigil también mostraron una mejora estadísticamente significativa en el estado clínico según la escala de CGI-C (p <0,001) [Tabla 2]. Las dos dosis de Provigil tuvieron un rendimiento similar.
En el segundo estudio, un ensayo multicéntrico controlado con placebo de 4 semanas, 157 pacientes fueron asignados al azar a Provigil 400 mg / día o placebo. Se requirió documentación del uso regular de CPAP (al menos 4 horas / noche en el 70% de las noches) para todos los pacientes. La medida de resultado primaria fue el cambio desde el inicio en el ESS en la semana 4 o la visita final. Las puntuaciones basales de ESS para los grupos Provigil y placebo fueron 14.2 y 14.4, respectivamente. En la semana 4, el ESS se redujo en 4.6 en el grupo de Provigil y en 2.0 en el grupo de placebo, una diferencia que fue estadísticamente significativa (p <0.0001).
El sueño nocturno medido con polisomnografía no se vio afectado por el uso de Provigil.
Trastorno del sueño por turnos de trabajo (SWSD)
La efectividad de Provigil para la somnolencia excesiva asociada con SWSD se demostró en un ensayo clínico de 12 semanas controlado con placebo. Un total de 209 pacientes con SWSD crónico fueron asignados al azar para recibir Provigil 200 mg / día o placebo. Todos los pacientes cumplieron con los criterios de la Clasificación Internacional de Trastornos del Sueño (ICSD-10) para SWSD crónico (que son de acuerdo con los criterios DSM-IV de la Asociación Americana de Psiquiatría para el trastorno del sueño del ritmo circadiano: trabajo por turnos Tipo). Estos criterios incluyen 1): a) una queja primaria de somnolencia excesiva o insomnio que se asocia temporalmente con un período de trabajo (generalmente trabajo nocturno) que ocurre durante la fase habitual del sueño, o b) la polisomnografía y el MSLT demuestran la pérdida de un patrón normal de sueño-vigilia (es decir, alteración cronobiológica ritmicidad); y 2) ningún otro trastorno médico o mental explica los síntomas, y 3) los síntomas no cumplen con los criterios para cualquier otro trastorno del sueño que produzca insomnio o somnolencia excesiva (por ejemplo, cambio de zona horaria [jet lag] síndrome).
Cabe señalar que no todos los pacientes con una queja de somnolencia que también participan en turnos cumplen con los criterios para el diagnóstico de SWSD. En el ensayo clínico, solo se incluyeron pacientes sintomáticos durante al menos 3 meses.
Los pacientes inscritos también debían trabajar un mínimo de 5 turnos nocturnos por mes, tener somnolencia excesiva en el hora de sus turnos nocturnos (puntaje MSLT <6 minutos), y tener insomnio durante el día documentado por un polisomnograma diurno (PSG)
Las principales medidas de efectividad fueron 1) latencia del sueño, según lo evaluado por la Prueba de latencia múltiple del sueño (MSLT) realizada durante un turno nocturno simulado en la semana 12 o la visita final y 2) el cambio en el estado general de la enfermedad del paciente, según lo medido por la Impresión clínica global de cambio (CGI-C) en la semana 12 o el final visitar. Los pacientes tratados con Provigil mostraron una prolongación estadísticamente significativa en el tiempo de inicio del sueño en comparación con los pacientes tratados con placebo, según lo medido por el MSLT nocturno [Tabla 1] (p <0.05). También se observó una mejora estadísticamente significativa en el CGI-C (p <0.001). (Ver Senderos clínicos, Sección de narcolepsia anterior para obtener una descripción de estas pruebas).
El sueño diurno medido con polisomnografía no se vio afectado por el uso de Provigil.
Portapapeles HTML
| Trastorno | Medida | Provigil 200 mg * |
Provigil 400 mg * |
Placebo | |||
| * Significativamente diferente al placebo para todos los ensayos (p <0.01 para todos los ensayos excepto SWSD, que fue p <0.05) | |||||||
| Base | Cambio de la línea de base |
Base | Cambio de la línea de base |
Base | Cambiar de Base |
||
| Narcolepsia I | MWT | 5.8 | 2.3 | 6.6 | 2.3 | 5.8 | -0.7 |
| Narcolepsia II | MWT | 6.1 | 2.2 | 5.9 | 2.0 | 6.0 | -0.7 |
| OSAHS | MWT | 13.1 | 1.6 | 13.6 | 1.5 | 13.8 | -1.1 |
| SWSD | MSLT | 2.1 | 1.7 | - | - | 2.0 | 0.3 |
| Trastorno | Provigil 200 mg * |
Provigil 400 mg * |
Placebo |
| * Significativamente diferente al placebo para todos los ensayos (p <0.01) | |||
| Narcolepsia I | 64% | 72% | 37% |
| Narcolepsia II | 58% | 60% | 38% |
| OSAHS | 61% | 68% | 37% |
| SWSD | 74% | - | 36% |
parte superior
Indicaciones y uso
Provigil está indicado para mejorar la vigilia en pacientes adultos con somnolencia excesiva asociada con narcolepsia, síndrome de apnea / hipopnea obstructiva del sueño y trastorno del sueño en el trabajo por turnos.
En OSAHS, Provigil está indicado como un complemento del tratamiento o tratamientos estándar para la obstrucción subyacente. Si la presión positiva continua en las vías respiratorias (CPAP) es el tratamiento de elección para un paciente, se debe realizar un esfuerzo máximo para tratar con CPAP durante un período de tiempo adecuado antes de iniciar Provigil. Si Provigil se usa de forma complementaria con CPAP, es necesario alentar y evaluar periódicamente el cumplimiento de CPAP.
En todos los casos, la atención cuidadosa al diagnóstico y tratamiento de los trastornos del sueño subyacentes es de suma importancia. Los prescriptores deben tener en cuenta que algunos pacientes pueden tener más de un trastorno del sueño que contribuye a su somnolencia excesiva.
La efectividad del modafinilo en el uso a largo plazo (más de 9 semanas en ensayos clínicos de narcolepsia y 12 semanas en ensayos clínicos OSAHS y SWSD) no se ha evaluado sistemáticamente en pacientes controlados con placebo juicios. El médico que elige recetar Provigil por un tiempo prolongado en pacientes con narcolepsia, SAHS o SWSD debe reevaluar periódicamente la utilidad a largo plazo para el paciente individual.
parte superior
Contraindicaciones
Provigil está contraindicado en pacientes con hipersensibilidad conocida a modafinilo, armodafinilo o sus ingredientes inactivos.
parte superior
Advertencias
Erupción grave, incluido el síndrome de Stevens-Johnson
Se ha informado de erupción cutánea grave que requiere hospitalización e interrupción del tratamiento en adultos y niños en asociación con el uso de modafinilo.
Modafinilo no está aprobado para su uso en pacientes pediátricos por ninguna indicación.
En los ensayos clínicos de modafinilo, la incidencia de erupción cutánea que provocó la interrupción fue de aproximadamente el 0,8% (13 por 1.585) en pacientes pediátricos (edad <17 años); Estas erupciones incluyeron 1 caso de posible síndrome de Stevens-Johnson (SJS) y 1 caso de reacción aparente de hipersensibilidad multiorgánica. Varios de los casos se asociaron con fiebre y otras anormalidades (por ejemplo, vómitos, leucopenia). La mediana del tiempo hasta la erupción que resultó en la interrupción fue de 13 días. No se observaron tales casos entre 380 pacientes pediátricos que recibieron placebo. No se han informado erupciones cutáneas graves en ensayos clínicos en adultos (0 por 4,264) de modafinilo.
Casos raros de erupción cutánea grave o potencialmente mortal, incluidos SSJ, necrólisis epidérmica tóxica (NET) y erupción farmacológica con Se ha informado de eosinofilia y síntomas sistémicos (DRESS) en adultos y niños en todo el mundo posterior a la comercialización. experiencia. La tasa de notificación de TEN y SJS asociada con el uso de modafinilo, que generalmente se acepta como una subestimación debido al subregistro, excede la tasa de incidencia de fondo. Las estimaciones de la tasa de incidencia de fondo para estas reacciones cutáneas graves en la población general oscilan entre 1 y 2 casos por millón de personas años.
No se conocen factores que predigan el riesgo de ocurrencia o la gravedad de la erupción asociada con modafinilo. Casi todos los casos de erupción cutánea grave asociada con modafinilo ocurrieron dentro de 1 a 5 semanas después del inicio del tratamiento. Sin embargo, se han informado casos aislados después de un tratamiento prolongado (por ejemplo, 3 meses). En consecuencia, no se puede confiar en la duración de la terapia como un medio para predecir el riesgo potencial anunciado por la primera aparición de una erupción.
Aunque las erupciones benignas también ocurren con modafinilo, no es posible predecir de manera confiable qué erupciones resultarán serias. En consecuencia, el modafinilo normalmente debe suspenderse al primer signo de erupción, a menos que la erupción claramente no esté relacionada con el medicamento. La interrupción del tratamiento no puede evitar que una erupción se convierta en una amenaza para la vida o en una discapacidad o desfiguración permanente.
Angioedema y reacciones anafilactoides
Un caso grave de angioedema y un caso de hipersensibilidad (con erupción cutánea, disfagia y broncoespasmo) fueron observado entre 1,595 pacientes tratados con armodafinilo, el enantiómero R de modafinilo (que es el racémico mezcla). No se observaron tales casos en ensayos clínicos de modafinilo. Sin embargo, se ha informado de angioedema en la experiencia posterior a la comercialización con modafinilo. Se debe aconsejar a los pacientes que interrumpan la terapia e inmediatamente informen a su médico cualquier signo o síntomas que sugieren angioedema o anafilaxia (por ejemplo, hinchazón de la cara, ojos, labios, lengua o laringe; dificultad para tragar o respirar; ronquera).
Reacciones de hipersensibilidad multiorgánica
Las reacciones de hipersensibilidad multiorgánica, incluida al menos una muerte en la experiencia posterior a la comercialización, tienen ocurrió en estrecha asociación temporal (tiempo medio de detección 13 días: rango 4-33) hasta el inicio de modafinilo
Aunque ha habido un número limitado de informes, las reacciones de hipersensibilidad multiorgánica pueden provocar hospitalización o poner en peligro la vida. No se conocen factores que predigan el riesgo de ocurrencia o la gravedad de las reacciones de hipersensibilidad multiorgánica asociadas con modafinilo. Los signos y síntomas de este trastorno fueron diversos; sin embargo, los pacientes típicamente, aunque no exclusivamente, presentaron fiebre y erupción cutánea asociada con otro compromiso del sistema orgánico. Otras manifestaciones asociadas incluyeron miocarditis, hepatitis, anomalías en las pruebas de función hepática, anomalías hematológicas (p. ej., eosinofilia, leucopenia, trombocitopenia), prurito y astenia. Debido a que la hipersensibilidad multiorgánica es variable en su expresión, pueden aparecer otros síntomas y signos del sistema orgánico, que no se mencionan aquí.
Si se sospecha una reacción de hipersensibilidad multiorgánica, se debe suspender Provigil. Aunque no hay informes de casos que indiquen sensibilidad cruzada con otras drogas que producen este síndrome, la experiencia con medicamentos asociados con hipersensibilidad multiorgánica indicaría que esto es un posibilidad.
Somnolencia persistente
Se debe informar a los pacientes con niveles anormales de somnolencia que toman Provigil que su nivel de vigilia puede no volver a la normalidad. Los pacientes con somnolencia excesiva, incluidos los que toman Provigil, deben ser reevaluados con frecuencia por sus grado de somnolencia y, si corresponde, se recomienda evitar conducir o cualquier otra actividad potencialmente peligrosa. Los prescriptores también deben ser conscientes de que los pacientes pueden no reconocer la somnolencia o la somnolencia hasta que se les pregunte directamente sobre la somnolencia o la somnolencia durante actividades específicas.
Síntomas psiquiátricos
Se han informado experiencias adversas psiquiátricas en pacientes tratados con modafinilo. Los eventos adversos posteriores a la comercialización asociados con el uso de modafinilo han incluido manía, delirios, alucinaciones, ideación suicida y agresión, algunos de los cuales resultaron en hospitalización. Muchos, pero no todos, los pacientes tenían antecedentes psiquiátricos previos. Un voluntario masculino sano desarrolló ideas de referencia, delirios paranoides y alucinaciones auditivas en asociación con múltiples dosis diarias de 600 mg de modafinilo y privación del sueño. No hubo evidencia de psicosis 36 horas después de la interrupción del fármaco.
En la base de datos de ensayos controlados de modafinilo en adultos, los síntomas psiquiátricos resultan en la interrupción del tratamiento (con una frecuencia> 0.3%) y se informa con mayor frecuencia en pacientes tratados con modafinilo en comparación con los tratados con placebo fueron ansiedad (1%), nerviosismo (1%), insomnio (<1%), confusión (<1%), agitación (<1%) y depresión (<1%). Se debe tener precaución cuando se administra Provigil a pacientes con antecedentes de psicosis, depresión o manía. Se debe considerar la posible aparición o exacerbación de los síntomas psiquiátricos en pacientes tratados con Provigil. Si se desarrollan síntomas psiquiátricos en asociación con la administración de Provigil, considere suspender Provigil.
parte superior
Precauciones
Diagnóstico de los trastornos del sueño.
Provigil debe usarse solo en pacientes que hayan tenido una evaluación completa de su somnolencia excesiva y en quienes El diagnóstico de narcolepsia, SAHS y / o SWSD se ha realizado de acuerdo con los criterios de diagnóstico de ICSD o DSM (Ver Senderos clínicos). Dicha evaluación generalmente consiste en una historia clínica completa y un examen físico, y puede complementarse con pruebas en un entorno de laboratorio. Algunos pacientes pueden tener más de un trastorno del sueño que contribuye a su somnolencia excesiva (por ejemplo, OSAHS y SWSD coincidentes en el mismo paciente).
General
Aunque no se ha demostrado que el modafinilo produzca un deterioro funcional, cualquier medicamento que afecte al SNC puede alterar el juicio, el pensamiento o las habilidades motoras. Se debe advertir a los pacientes sobre la operación de un automóvil u otra maquinaria peligrosa hasta que estén razonablemente seguro de que la terapia con Provigil no afectará negativamente su capacidad para participar en tales ocupaciones.
Uso de CPAP en pacientes con SAHS
En OSAHS, Provigil está indicado como un complemento del tratamiento o tratamientos estándar para la obstrucción subyacente. Si la presión positiva continua en las vías respiratorias (CPAP) es el tratamiento de elección para un paciente, se debe realizar un esfuerzo máximo para tratar con CPAP durante un período de tiempo adecuado antes de iniciar Provigil. Si Provigil se usa de forma complementaria con CPAP, es necesario alentar y evaluar periódicamente el cumplimiento de CPAP.
Sistema cardiovascular
El modafinilo no se ha evaluado en pacientes con antecedentes recientes de infarto de miocardio o angina inestable, y dichos pacientes deben ser tratados con precaución.
En estudios clínicos de Provigil, los signos y síntomas incluyen dolor torácico, palpitaciones, disnea e isquemia transitoria. Se observaron cambios en la onda T en el ECG en tres sujetos en asociación con prolapso de la válvula mitral o ventricular izquierdo hipertrofia. Se recomienda que los comprimidos de Provigil no se utilicen en pacientes con antecedentes de hipertrofia ventricular izquierda o en pacientes con prolapso de la válvula mitral que han experimentado el síndrome de prolapso de la válvula mitral cuando recibieron SNC previamente estimulantes Tales signos pueden incluir, entre otros, cambios isquémicos en el ECG, dolor torácico o arritmia. Si se produce un nuevo inicio de cualquiera de estos síntomas, considere la evaluación cardíaca.
La monitorización de la presión arterial en ensayos controlados a corto plazo (<3 meses) no mostró clínicamente significativo cambios en la presión arterial sistólica y diastólica media en pacientes que reciben Provigil en comparación con placebo. Sin embargo, un análisis retrospectivo del uso de medicamentos antihipertensivos en estos estudios mostró que una mayor proporción de los pacientes que recibieron Provigil requirieron un uso nuevo o mayor de medicamentos antihipertensivos (2.4%) en comparación con los pacientes que recibieron placebo (0.7%). El uso diferencial fue ligeramente mayor cuando solo se incluyeron estudios en SAHS, con 3.4% de pacientes en Provigil y el 1.1% de los pacientes con placebo que requieren tales alteraciones en el uso de antihipertensivos medicación. El aumento de la monitorización de la presión arterial puede ser apropiado en pacientes con Provigil.
Pacientes que usan anticonceptivos esteroideos
La efectividad de los anticonceptivos esteroideos se puede reducir cuando se usa con tabletas Provigil y durante un mes después de la interrupción de la terapia (ver Precauciones, Interacciones con la drogas). Se recomiendan métodos anticonceptivos alternativos o concomitantes para pacientes tratadas con tabletas de Provigil y durante un mes después de la interrupción de Provigil.
Pacientes que usan ciclosporina
Los niveles sanguíneos de ciclosporina pueden reducirse cuando se usa con Provigil (Ver Precauciones, Interacciones con la drogas). El monitoreo de las concentraciones circulantes de ciclosporina y el ajuste de dosis apropiado para la ciclosporina deben considerarse cuando estos medicamentos se usan concomitantemente.
Pacientes con insuficiencia hepática severa
En pacientes con insuficiencia hepática grave, con o sin cirrosis (ver Farmacología Clínica), Provigil se debe administrar a una dosis reducida (ver Dosificación y administración).
Pacientes con insuficiencia renal severa
No hay información adecuada para determinar la seguridad y la eficacia de la dosificación en pacientes con insuficiencia renal grave. (Para farmacocinética en insuficiencia renal, ver Farmacología Clínica.)
Pacientes de edad avanzada
En pacientes de edad avanzada, la eliminación de modafinilo y sus metabolitos puede reducirse como consecuencia del envejecimiento. Por lo tanto, se debe considerar el uso de dosis más bajas en esta población. (Ver Farmacología Clínica y Dosificación y administración).
Información para pacientes
Se aconseja a los médicos que discutan los siguientes problemas con los pacientes a quienes les recetan Provigil.
Provigil está indicado para pacientes con niveles anormales de somnolencia. Se ha demostrado que Provigil mejora, pero no elimina esta tendencia anormal a quedarse dormido. Por lo tanto, los pacientes no deben alterar su comportamiento anterior con respecto a actividades potencialmente peligrosas (por ejemplo, conducir, operar maquinaria) u actividades que requieren niveles apropiados de vigilia, hasta que se haya demostrado que el tratamiento con Provigil produce niveles de vigilia que permiten tal ocupaciones. Se debe informar a los pacientes que Provigil no reemplaza el sueño.
Se debe informar a los pacientes que puede ser crítico que continúen tomando sus tratamientos previamente recetados (por ejemplo, los pacientes con SAHS que reciben CPAP deben continuar haciéndolo).
Se debe informar a los pacientes sobre la disponibilidad de un folleto informativo para el paciente, y se les debe indicar que lo lean antes de tomar Provigil.
Se debe aconsejar a los pacientes que se pongan en contacto con su médico si experimentan dolor en el pecho, sarpullido, depresión, ansiedad o signos de psicosis o manía.
El embarazo
Se debe recomendar a las pacientes que notifiquen a su médico si quedan embarazadas o si tienen la intención de quedar embarazadas durante la terapia. Se debe advertir a las pacientes sobre el posible aumento del riesgo de embarazo al usar anticonceptivos esteroideos (incluidos los de depósito o implantables). anticonceptivos) con Provigil y durante un mes después de la interrupción de la terapia (ver carcinogénesis, mutagénesis, deterioro de la fertilidad y El embarazo).
Enfermería
Se debe aconsejar a los pacientes que notifiquen a su médico si están amamantando a un bebé.
Medicación concomitante
Se debe aconsejar a los pacientes que informen a su médico si están tomando, o planean tomar, cualquier medicamentos recetados o de venta libre, debido al potencial de interacciones entre Provigil y otras drogas.
Alcohol
Se debe informar a los pacientes que no se ha estudiado el uso de Provigil en combinación con alcohol. Se debe advertir a los pacientes que es prudente evitar el alcohol mientras toman Provigil.
Reacciones alérgicas
Se debe aconsejar a los pacientes que dejen de tomar Provigil y que notifiquen a su médico si desarrollan una erupción cutánea. urticaria, llagas en la boca, ampollas, descamación de la piel, dificultad para tragar o respirar o una alergia relacionada fenómeno.
Interacciones con la drogas
Drogas activas del SNC
Metilfenidato
En un estudio de dosis única en voluntarios sanos, administración simultánea de modafinilo (200 mg) con el metilfenidato (40 mg) no causó ninguna alteración significativa en la farmacocinética de ninguno de los dos fármaco. Sin embargo, la absorción de Provigil puede retrasarse aproximadamente una hora cuando se administra conjuntamente con metilfenidato.
En un estudio de dosis múltiples en estado estacionario en voluntarios sanos, se administró modafinilo una vez al día a 200 mg / día durante 7 días seguido de 400 mg / día durante 21 días. Administración de metilfenidato (20 mg / día) durante los días 22-28 del tratamiento con modafinilo 8 horas después la dosis diaria de modafinilo no causó alteraciones significativas en la farmacocinética de modafinilo
Dextroanfetamina
En un estudio de dosis única en voluntarios sanos, administración simultánea de modafinilo (200 mg) con la dextroanfetamina (10 mg) no causó ninguna alteración significativa en la farmacocinética de ninguno de los dos fármaco. Sin embargo, la absorción de Provigil puede retrasarse aproximadamente una hora cuando se administra conjuntamente con dextroanfetamina.
En un estudio de dosis múltiples en estado estacionario en voluntarios sanos, se administró modafinilo una vez al día a 200 mg / día durante 7 días seguido de 400 mg / día durante 21 días. Administración de dextroanfetamina (20 mg / día) durante los días 22-28 del tratamiento con modafinilo 7 horas después la dosis diaria de modafinilo no causó alteraciones significativas en la farmacocinética de modafinilo
Clomipramina
La administración conjunta de una dosis única de clomipramina (50 mg) en el primero de los tres días de tratamiento con El modafinilo (200 mg / día) en voluntarios sanos no mostró un efecto sobre la farmacocinética de ninguno de los fármacos. Sin embargo, se ha informado un incidente de aumento de los niveles de clomipramina y su metabolito activo desmetilclomipramina en un paciente con narcolepsia durante el tratamiento con modafinilo.
Triazolam
En el estudio de interacción farmacológica entre Provigil y etinilestradiol (EE2), en los mismos días que los de En el muestreo de plasma para la farmacocinética de EE2, también se administró una dosis única de triazolam (0,125 mg). La Cmax media y el AUC0-β de triazolam disminuyeron en un 42% y 59%, respectivamente, y su vida media de eliminación disminuyó aproximadamente una hora después del tratamiento con modafinilo.
Inhibidores de la monoaminooxidasa (MAO)
No se han realizado estudios de interacción con inhibidores de la monoaminooxidasa. Por lo tanto, se debe tener precaución al administrar concomitantemente inhibidores de la MAO y modafinilo.
Otras drogas
Warfarina
No hubo cambios significativos en los perfiles farmacocinéticos de warfarina R y S en sujetos sanos que recibieron una dosis única de warfarina racémica (5 mg) después de la administración crónica de modafinilo (200 mg / día durante 7 días seguido de 400 mg / día durante 27 días) en relación con los perfiles en los sujetos administrados placebo. Sin embargo, se recomienda un monitoreo más frecuente de los tiempos de protrombina / INR cada vez que Provigil se coadministra con warfarina (ver Farmacología Clínica, Farmacocinética, interacciones farmacológicas).
Etinilestradiol
Administración de modafinilo a mujeres voluntarias una vez al día a 200 mg / día durante 7 días seguido de 400 mg / día durante 21 días resultó en una disminución promedio del 11% en la Cmáx y una disminución del 18% en el AUC0-24 de etinilestradiol (EE2; 0,035 mg; administrado por vía oral con norgestimato). No hubo cambios aparentes en la tasa de eliminación de etinilestradiol.
Ciclosporina
Se informó un caso de interacción entre modafinilo y ciclosporina, un sustrato de CYP3A4, en una mujer de 41 años que se había sometido a un trasplante de órgano. Después de un mes de administración de 200 mg / día de modafinilo, los niveles de ciclosporina en sangre disminuyeron en un 50%. Se postuló que la interacción se debía al aumento del metabolismo de la ciclosporina, ya que ningún otro factor que se esperaba que afectara la disposición del medicamento había cambiado. Puede ser necesario un ajuste de la dosis de ciclosporina.
Posibles interacciones con medicamentos que inhiben, inducen o se metabolizan por las isoenzimas del citocromo P-450 y otras enzimas hepáticas
En estudios in vitro con cultivos primarios de hepatocitos humanos, se demostró que modafinilo induce ligeramente a CYP1A2, CYP2B6 y CYP3A4 de manera dependiente de la concentración. Aunque los resultados de la inducción basados en experimentos in vitro no necesariamente predicen la respuesta in vivo, tenga cuidado debe ejercerse cuando Provigil se coadministra con medicamentos que dependen de estas tres enzimas para su despeje. Específicamente, podrían producirse niveles sanguíneos más bajos de dichos medicamentos (ver Otros medicamentos, Ciclosporinea anteriormente).
La exposición de los hepatocitos humanos a modafinilo in vitro produjo una aparente supresión relacionada con la concentración de la expresión de la actividad CYP2C9 sugiriendo que existe la posibilidad de una interacción metabólica entre el modafinilo y los sustratos de esta enzima (por ejemplo, S-warfarina y fenitoína). En un estudio clínico posterior en voluntarios sanos, el tratamiento crónico con modafinilo no mostró un efecto significativo sobre la farmacocinética de dosis única de warfarina en comparación con placebo (ver Precauciones, Interacciones farmacológicas, warfarina).
Los estudios in vitro con microsomas hepáticos humanos mostraron que el modafinilo inhibía reversiblemente el CYP2C19 a concentraciones farmacológicamente relevantes de modafinilo. CYP2C19 también se inhibe de forma reversible, con una potencia similar, por un metabolito circulante, modafinil sulfona. Aunque las concentraciones plasmáticas máximas de modafinil sulfona son mucho más bajas que las de los padres modafinilo, el efecto combinado de ambos compuestos podría producir una inhibición parcial sostenida de enzima. Medicamentos que se eliminan en gran medida a través del metabolismo CYP2C19, como el diazepam, el propranolol, la fenitoína (también a través de CYP2C9) o La S-mefenitoína puede tener una eliminación prolongada tras la administración conjunta con Provigil y puede requerir la reducción de la dosis y el control por toxicidad
Antidepresivos tricíclicos
CYP2C19 también proporciona una vía auxiliar para el metabolismo de ciertos antidepresivos tricíclicos (por ejemplo, clomipramina y desipramina) que se metabolizan principalmente por CYP2D6. En pacientes tratados con tricíclicos deficientes en CYP2D6 (es decir, aquellos que son metabolizadores lentos de la debrisoquina; 7-10% de la población caucásica; similar o inferior en otras poblaciones), la cantidad de metabolismo por CYP2C19 puede aumentar sustancialmente. Provigil puede causar elevación de los niveles de los tricíclicos en este subconjunto de pacientes. Los médicos deben ser conscientes de que podría ser necesaria una reducción en la dosis de agentes tricíclicos en estos pacientes.
Además, debido a la participación parcial de CYP3A4 en la eliminación metabólica de modafinilo, la administración conjunta de inductores potentes de CYP3A4 (p. ej., carbamazepina, fenobarbital, rifampicina) o inhibidores de CYP3A4 (p. ej., ketoconazol, itraconazol) podrían alterar los niveles plasmáticos de modafinilo
Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis
Se realizaron estudios de carcinogenicidad en los que se administró modafinilo en la dieta a ratones durante 78 semanas y a ratas durante 104 semanas a dosis de 6, 30 y 60 mg / kg / día. La dosis más alta estudiada es 1.5 (ratón) o 3 (rata) veces mayor que la dosis diaria recomendada para adultos de modafinilo (200 mg) en una base de mg / m2. No hubo evidencia de tumorigénesis asociada con la administración de modafinilo en estos estudios. Sin embargo, dado que el estudio en ratones utilizó una dosis alta inadecuada que no era representativa de una dosis máxima tolerada, se realizó un estudio de carcinogenicidad posterior en la Tg. Ratón AC transgénico. Dosis evaluadas en la Tg. El ensayo de CA fue de 125, 250 y 500 mg / kg / día, administrados por vía cutánea. No hubo evidencia de tumorigenicidad asociada con la administración de modafinilo; sin embargo, este modelo dérmico puede no evaluar adecuadamente el potencial carcinogénico de un medicamento administrado por vía oral.
Mutagénesis
El modafinilo no demostró evidencia de potencial mutagénico o clastogénico en una serie de ensayos in vitro (es decir, ensayo de mutación inversa bacteriana, ensayo de linfoma de ratón tk, aberración cromosómica ensayo en linfocitos humanos, ensayo de transformación celular en células embrionarias de ratón BALB / 3T3) ensayos en ausencia o presencia de activación metabólica, o in vivo (micronúcleo de médula ósea de ratón) ensayos El modafinilo también fue negativo en el ensayo de síntesis de ADN no programado en hepatocitos de rata.
Deterioro de la fertilidad
Administración oral de modafinilo (dosis de hasta 480 mg / kg / día) a ratas machos y hembras antes y durante el apareamiento y continuar en las hembras hasta el día 7 de gestación produjo un aumento en el tiempo de apareamiento en el momento más alto dosis; No se observaron efectos sobre otros parámetros de fertilidad o reproducción. La dosis sin efecto de 240 mg / kg / día se asoció con una exposición plasmática de modafinilo (AUC) aproximadamente igual a la de los humanos a la dosis recomendada de 200 mg.
El embarazo
Embarazo Categoría C:
En estudios realizados en ratas y conejos, se observó toxicidad en el desarrollo en exposiciones clínicamente relevantes.
Modafinilo (50, 100 o 200 mg / kg / día) administrado por vía oral a ratas preñadas durante el período de organogénesis causada, en ausencia de toxicidad materna, un aumento en las reabsorciones y una mayor incidencia de variaciones viscerales y esqueléticas en la descendencia en el nivel más alto dosis. La dosis más alta sin efecto para la toxicidad del desarrollo embriofetal de rata se asoció con un plasma exposición a modafinilo aproximadamente 0.5 veces el AUC en humanos a la dosis diaria recomendada (RHD) de 200 mg. Sin embargo, en un estudio posterior de hasta 480 mg / kg / día (exposición de modafinilo en plasma aproximadamente 2 veces el AUC en humanos en el RHD) no se observaron efectos adversos sobre el desarrollo embriofetal.
Modafinilo administrado por vía oral a conejos preñadas durante todo el período de organogénesis a dosis de 45, 90 y 180 mg / kg / día aumentaron la incidencia de alteraciones estructurales fetales y muerte embriofetal a la dosis más alta. La dosis más alta sin efecto para la toxicidad del desarrollo se asoció con un AUC de modafinilo en plasma aproximadamente igual al AUC en humanos en el RHD.
Administración oral de armodafinilo (el enantiómero R de modafinilo; 60, 200 o 600 mg / kg / día) a ratas preñadas durante todo el período de organogénesis dio como resultado una mayor incidencia de variaciones viscerales y esqueléticas fetales en la dosis intermedia o mayor y disminución de los pesos corporales fetales en la dosis más alta dosis. La dosis sin efecto para la toxicidad del desarrollo embriofetal de rata se asoció con un armodafinilo en plasma. exposición (AUC) aproximadamente una décima vez la AUC para armodafinilo en humanos tratados con modafinilo en el RHD.
La administración de modafinilo a ratas durante la gestación y la lactancia a dosis orales de hasta 200 mg / kg / día resultó en una disminución viabilidad en la descendencia a dosis mayores de 20 mg / kg / día (AUC modafinilo en plasma aproximadamente 0.1 veces el AUC en humanos en el RHD). No se observaron efectos sobre el desarrollo postnatal y los parámetros neuroconductuales en las crías supervivientes.
No existen estudios adecuados y bien controlados en mujeres embarazadas. Se han notificado dos casos de retraso del crecimiento intrauterino y un caso de aborto espontáneo en asociación con armodafinilo y modafinilo. Aunque la farmacología del modafinilo y el armodafinilo no es idéntica a la de las aminas simpaticomiméticas, sí comparten algunas propiedades farmacológicas con esta clase. Algunos de estos medicamentos se han asociado con retraso del crecimiento intrauterino y abortos espontáneos. Se desconoce si los casos reportados están relacionados con las drogas.
El modafinilo debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Trabajo y entrega
El efecto del modafinilo sobre el trabajo de parto y el parto en humanos no se ha investigado sistemáticamente.
Madres lactantes
No se sabe si modafinilo o sus metabolitos se excretan en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana, se debe tener precaución cuando las tabletas de Provigil se administran a una mujer lactante.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos, menores de 16 años. Las erupciones cutáneas graves, incluido el eritema multiforme mayor (EMM) y el síndrome de Stevens-Johnson (SJS) se han asociado con el uso de modafinilo en pacientes pediátricos (ver Advertencias, Erupción grave, incluido el síndrome de Stevens-Johnson).
En un estudio controlado de 6 semanas, 165 pacientes pediátricos (de 5 a 17 años) con narcolepsia fueron tratados con modafinilo (n = 123) o placebo (n = 42). No hubo diferencias estadísticamente significativas a favor de modafinilo sobre placebo en la prolongación de la latencia del sueño como medido por MSLT, o en percepciones de somnolencia según lo determinado por la escala clínica de impresión clínica global (CGI-C).
En los estudios clínicos controlados y abiertos, el tratamiento de los eventos adversos emergentes del sistema psiquiátrico y nervioso incluido el síndrome de Tourette, insomnio, hostilidad, aumento de cataplejía, aumento de alucinaciones hipnagógicas y suicidio ideación También se observó leucopenia transitoria, que se resolvió sin intervención médica. En el estudio clínico controlado, 3 de 38 niñas, de 12 años o más, tratadas con modafinilo experimentaron dismenorrea en comparación con 0 de 10 niñas que recibieron placebo.
Uso geriátrico
No se ha establecido la seguridad y eficacia en personas mayores de 65 años. La experiencia en un número limitado de pacientes mayores de 65 años en ensayos clínicos mostró una incidencia de experiencias adversas similar a la de otros grupos de edad.
parte superior
Reacciones adversas
Se ha evaluado la seguridad de modafinilo en más de 3500 pacientes, de los cuales más de 2000 pacientes con exceso somnolencia asociada con trastornos primarios del sueño y la vigilia se les dio al menos una dosis de modafinilo En ensayos clínicos, se ha encontrado que el modafinilo es generalmente bien tolerado y la mayoría de las experiencias adversas fueron de leves a moderadas.
Los eventos adversos más comúnmente observados (â ‰ ¥ 5%) asociados con el uso de Provigil con más frecuencia que los pacientes tratados con placebo en pacientes controlados con placebo Los estudios clínicos en trastornos primarios del sueño y la vigilia fueron dolor de cabeza, náuseas, nerviosismo, rinitis, diarrea, dolor de espalda, ansiedad, insomnio, mareos y dispepsia. El perfil de eventos adversos fue similar en todos estos estudios.
En los ensayos clínicos controlados con placebo, 74 de los 934 pacientes (8%) que recibieron Provigil interrumpieron debido a una experiencia adversa en comparación con el 3% de los pacientes que recibieron placebo. Las razones más frecuentes para la interrupción que ocurrieron a una tasa más alta para Provigil que el placebo los pacientes fueron dolor de cabeza (2%), náuseas, ansiedad, mareos, insomnio, dolor en el pecho y nerviosismo (cada uno <1%). En un ensayo clínico canadiense, un hombre narcoleptico obeso de 35 años de edad con antecedentes de episodios sincopales. experimentó un episodio de 9 segundos de asistolia después de 27 días de tratamiento con modafinilo (300 mg / día en forma dividida dosis).
Incidencia en ensayos controlados
La siguiente tabla (Tabla 3) presenta las experiencias adversas que ocurrieron a una tasa de 1% o más y fueron más frecuentes en pacientes adultos tratados con Provigil que en pacientes tratados con placebo en la clínica principal controlada con placebo juicios.
El prescriptor debe ser consciente de que las cifras proporcionadas a continuación no pueden usarse para predecir la frecuencia de las experiencias adversas en el curso de la práctica médica habitual, donde las características del paciente y otros factores pueden diferir de los que ocurren durante la clínica estudios. Del mismo modo, las frecuencias citadas no se pueden comparar directamente con las cifras obtenidas de otras investigaciones clínicas que involucran diferentes tratamientos, usos o investigadores. Sin embargo, la revisión de estas frecuencias proporciona a los prescriptores una base para estimar la contribución relativa de los factores farmacológicos y no farmacológicos a la incidencia de eventos adversos en la población estudiada.
| Sistema corporal | Término preferido | Modafinilo (n = 934) |
Placebo (n = 567) |
| * Seis estudios clínicos doble ciego, controlados con placebo en narcolepsia, OSAHS y SWSD. 1 Se incluyen los eventos informados por al menos el 1% de los pacientes tratados con Provigil que fueron más frecuentes que en el grupo placebo; la incidencia se redondea al 1% más cercano. La terminología de la experiencia adversa se codifica utilizando un Diccionario COSTART modificado estándar. Los eventos para los cuales la incidencia de Provigil fue al menos 1%, pero igual o menor que el placebo no se enumeran en la tabla. Estos eventos incluyeron los siguientes: infección, dolor, lesión accidental, dolor abdominal, hipotermia, reacción alérgica, astenia, fiebre, infección viral, dolor de cuello, migraña, electrocardiograma anormal, hipotensión, trastorno dental, vómitos, absceso periodontal, aumento del apetito, equimosis, hiperglucemia, edema periférico, pérdida de peso, peso ganancia, mialgia, calambres en las piernas, artritis, cataplejía, anormalidad del pensamiento, trastorno del sueño, aumento de la tos, sinusitis, disnea, bronquitis, erupción cutánea, conjuntivitis, dolor de oído, dismenorrea4, infección del tracto urinario. 2 Elevación de las enzimas hepáticas. 3 Disquinesias orofaciales. 4 Incidencia ajustada por género. | |||
| Cuerpo como un todo | Dolor de cabeza | 34% | 23% |
| Dolor de espalda | 6% | 5% | |
| Síndrome de gripe | 4% | 3% | |
| Dolor de pecho | 3% | 1% | |
| Resfriado | 1% | 0% | |
| Rigidez en cuello | 1% | 0% | |
| Cardiovascular | Hipertensión | 3% | 1% |
| Taquicardia | 2% | 1% | |
| Palpitación | 2% | 1% | |
| Vasodilatación | 2% | 0% | |
| Digestivo | Náusea | 11% | 3% |
| Diarrea | 6% | 5% | |
| Dispepsia | 5% | 4% | |
| Boca seca | 4% | 2% | |
| Anorexia | 4% | 1% | |
| Estreñimiento | 2% | 1% | |
| Función hepática anormal2 | 2% | 1% | |
| Flatulencia | 1% | 0% | |
| Ulceración de la boca | 1% | 0% | |
| Sed | 1% | 0% | |
| Hemático / Linfático | Eosinofilia | 1% | 0% |
| Metabólico / Nutricional | Edema | 1% | 0% |
| Nervioso | Nerviosismo | 7% | 3% |
| Insomnio | 5% | 1% | |
| Ansiedad | 5% | 1% | |
| Mareo | 5% | 4% | |
| Depresión | 2% | 1% | |
| Parestesia | 2% | 0% | |
| Somnolencia | 2% | 1% | |
| Hipertonia | 1% | 0% | |
| Discinesia3 | 1% | 0% | |
| Hipercinesia | 1% | 0% | |
| Agitación | 1% | 0% | |
| Confusión | 1% | 0% | |
| Temblor | 1% | 0% | |
| Labilidad emocional | 1% | 0% | |
| Vértigo | 1% | 0% | |
| Respiratorio | Rinitis | 7% | 6% |
| Faringitis | 4% | 2% | |
| Trastorno pulmonar | 2% | 1% | |
| Epistaxis | 1% | 0% | |
| Asma | 1% | 0% | |
| Piel / Apéndices | Transpiración | 1% | 0% |
| Herpes Simple | 1% | 0% | |
| Sentidos especiales | Ambliopía | 1% | 0% |
| Visión anormal | 1% | 0% | |
| Perversión del gusto | 1% | 0% | |
| Dolor de ojo | 1% | 0% | |
| Urogenital | Anormalidad de la orina | 1% | 0% |
| Hematuria | 1% | 0% | |
| Pyuria | 1% | 0% |
Dependencia de dosis de eventos adversos
En los ensayos clínicos para adultos controlados con placebo que compararon dosis de 200, 300 y 400 mg / día de Provigil y placebo, los únicos eventos adversos que estaban claramente relacionados con la dosis fueron dolor de cabeza y ansiedad.
Cambios de signos vitales
Si bien no hubo un cambio constante en los valores medios de la frecuencia cardíaca o la presión arterial sistólica y diastólica, el El requerimiento de medicación antihipertensiva fue ligeramente mayor en pacientes con Provigil en comparación con placebo (Ver Precauciones).
Cambios de peso
No hubo diferencias clínicamente significativas en el cambio de peso corporal en los pacientes tratados con Provigil en comparación con los pacientes tratados con placebo en los ensayos clínicos controlados con placebo.
Cambios de laboratorio
Los parámetros de química clínica, hematología y análisis de orina se monitorearon en los estudios de fase 1, 2 y 3. En estos estudios, los niveles plasmáticos medios de gamma glutamiltransferasa (GGT) y fosfatasa alcalina (AP) fueron mayores después de la administración de Provigil, pero no placebo. Pocos sujetos, sin embargo, tuvieron elevaciones de GGT o AP fuera del rango normal. Cambios a valores más altos, pero no clínicamente significativamente anormales, los valores de GGT y AP parecieron aumentar con el tiempo en la población tratada con Provigil en los ensayos clínicos de fase 3. No se observaron diferencias en alanina aminotransferasa, aspartato aminotransferasa, proteína total, albúmina o bilirrubina total.
Cambios de ECG
No se encontró un patrón emergente de tratamiento de anormalidades en el ECG en ensayos clínicos controlados con placebo después de la administración de Provigil.
Informes posteriores a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de Provigil. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco. Las decisiones de incluir estas reacciones en el etiquetado generalmente se basan en uno o más de los siguientes factores: (1) seriedad de la reacción, (2) frecuencia del informe o (3) fuerza de la conexión causal con Provigil.
Hematológico: agranulocitosis
parte superior
Abuso y dependencia de drogas
Clase de sustancia controlada
El modafinilo (Provigil) figura en el Anexo IV de la Ley de Sustancias Controladas.
Potencial de abuso y dependencia
Además de su efecto que promueve la vigilia y el aumento de la actividad locomotora en animales, en humanos, Provigil produce efectos psicoactivos y eufóricos, alteraciones en el estado de ánimo, percepción, pensamiento y sentimientos típicos de otros estimulantes del SNC. En estudios de unión in vitro, el modafinilo se une al sitio de recaptación de dopamina y provoca un aumento en la dopamina extracelular, pero no aumenta la liberación de dopamina. El modafinilo se está reforzando, como lo demuestra su autoadministración en monos previamente entrenados para autoadministrarse cocaína. En algunos estudios, el modafinilo también fue parcialmente discriminado como estimulante. Los médicos deben seguir de cerca a los pacientes, especialmente aquellos con antecedentes de abuso de drogas y / o estimulantes (por ejemplo, metilfenidato, anfetamina o cocaína). Se debe observar a los pacientes en busca de signos de mal uso o abuso (por ejemplo, aumento de dosis o comportamiento de búsqueda de drogas).
El potencial de abuso de modafinilo (200, 400 y 800 mg) se evaluó en relación con el metilfenidato (45 y 90 mg) en un estudio de pacientes hospitalizados en individuos con drogas de abuso. Los resultados de este estudio clínico demostraron que el modafinilo produce efectos psicoactivos y eufóricos y sentimientos consistentes con otros estimulantes programados del SNC (metilfenidato).
Retirada
Los efectos de la abstinencia de modafinilo se monitorizaron después de 9 semanas de uso de modafinilo en un ensayo clínico controlado de fase 3 en EE. UU. No se observaron síntomas específicos de abstinencia durante los 14 días de observación, aunque la somnolencia regresó en pacientes narcolépticos.
parte superior
Sobredosis
Experiencia humana
En ensayos clínicos, un total de 151 dosis especificadas por el protocolo que van desde 1000 a 1600 mg / día (5 a 8 veces la dosis diaria recomendada de 200 mg) se han administrado a 32 sujetos, incluidos 13 sujetos que recibieron dosis de 1000 o 1200 mg / día durante 7 a 21 consecutivos dias. Además, ocurrieron varias sobredosis agudas intencionales; los dos más grandes son 4500 mg y 4000 mg tomados por dos sujetos que participan en estudios de depresión extranjera. Ninguno de estos sujetos de estudio experimentó efectos inesperados o potencialmente mortales. Las experiencias adversas que se informaron con estas dosis incluyeron excitación o agitación, insomnio y elevaciones leves o moderadas en los parámetros hemodinámicos. Otros efectos de dosis altas observados en estudios clínicos han incluido ansiedad, irritabilidad, agresividad, confusión, nerviosismo, temblor, palpitaciones, trastornos del sueño, náuseas, diarrea y disminución de la protrombina hora.
Desde la experiencia posterior a la comercialización, no ha habido informes de sobredosis fatales que involucren modafinilo solo (dosis de hasta 12 gramos). Las sobredosis que involucran múltiples medicamentos, incluido el modafinilo, han tenido resultados fatales. Los síntomas que con mayor frecuencia acompañan a una sobredosis de modafinilo, solos o en combinación con otras drogas han incluido: insomnio; síntomas del sistema nervioso central tales como inquietud, desorientación, confusión, excitación y alucinaciones; cambios digestivos como náuseas y diarrea; y cambios cardiovasculares como taquicardia, bradicardia, hipertensión y dolor torácico.
Se han notificado casos de ingestión / sobredosis accidentales en niños de hasta 11 meses de edad. La ingestión accidental más alta reportada en mg / kg ocurrió en un niño de tres años que ingirió 800-1000 mg (50-63 mg / kg) de modafinilo. El niño se mantuvo estable. Los síntomas asociados con una sobredosis en niños fueron similares a los observados en adultos.
Manejo de sobredosis
Hasta la fecha no se ha identificado ningún antídoto específico para los efectos tóxicos de la sobredosis de modafinilo. Tales sobredosis deben manejarse con atención principalmente de apoyo, incluida la monitorización cardiovascular. Si no hay contraindicaciones, se debe considerar la emesis inducida o el lavado gástrico. No hay datos que sugieran la utilidad de la diálisis o la acidificación o alcalinización urinaria para mejorar la eliminación del fármaco. El médico debe considerar ponerse en contacto con un centro de control de intoxicaciones para el tratamiento de cualquier sobredosis.
parte superior
Dosificación y administración
La dosis recomendada de Provigil es de 200 mg administrados una vez al día.
Para pacientes con narcolepsia y SAHS, Provigil debe tomarse como una dosis única por la mañana.
Para los pacientes con SWSD, Provigil debe tomarse aproximadamente 1 hora antes del inicio de su turno de trabajo.
Las dosis de hasta 400 mg / día, administradas como una dosis única, han sido bien toleradas, pero no hay evidencia consistente de que esta dosis confiera un beneficio adicional más allá de la dosis de 200 mg (ver Farmacología Clínica y Senderos clínicos).
Consideraciones Generales
Se debe considerar el ajuste de la dosis para los medicamentos concomitantes que son sustratos del CYP3A4, como el triazolam y la ciclosporina (ver Precauciones, Interacciones con la drogas).
Medicamentos que se eliminan en gran medida a través del metabolismo CYP2C19, como el diazepam, el propranolol, la fenitoína (también a través de CYP2C9) o La S-mefenitoína puede tener una eliminación prolongada tras la administración conjunta con Provigil y puede requerir la reducción de la dosis y el control por toxicidad
En pacientes con insuficiencia hepática grave, la dosis de Provigil debe reducirse a la mitad de la recomendada para pacientes con función hepática normal (ver CFarmacología Clínica y Precauciones).
No hay información adecuada para determinar la seguridad y la eficacia de la dosificación en pacientes con insuficiencia renal grave (ver Farmacología Clínica y Precauciones).
En pacientes de edad avanzada, la eliminación de Provigil y sus metabolitos puede reducirse como consecuencia del envejecimiento. Por lo tanto, se debe considerar el uso de dosis más bajas en esta población (Ver Farmacología Clínica y Precauciones).
parte superior
Cómo suministrado
Provigil® (modafinilo) tabletas
100 mg: cada tableta blanca, sin recubrimiento, en forma de cápsula está grabada con "Provigil" en un lado y "100 MG" en el otro.
NDC 63459-101-01 - Botellas de 100
200 mg: cada tableta con forma de cápsula, blanca, ranurada y sin recubrimiento está grabada con "Provigil" en un lado y "200 MG" en el otro.
NDC 63459-201-01 - Botellas de 100
Almacene a 20 ° - 25 ° C (68 ° - 77 ° F).
Fabricado para:
Cephalon, Inc.
Frazer, PA 19355
Patentes de EE. UU. RE37,516 / 4,927,855
© Cephalon, Inc., 2008. Todos los derechos reservados
PROV-011
Última actualización: 03/08
Provigil (modafinil) hoja de información para el paciente (en inglés simple)
Información detallada sobre Signos, síntomas, causas, tratamientos de los trastornos del sueño
La información en esta monografía no pretende cubrir todos los usos, instrucciones, precauciones, interacciones de drogas o efectos adversos posibles. Esta información es generalizada y no pretende ser un consejo médico específico. Si tiene preguntas sobre los medicamentos que está tomando o desea obtener más información, consulte con su médico, farmacéutico o enfermero.
de regreso:
~ todos los artículos sobre trastornos del sueño


