Namenda: medicación para el Alzheimer
Namenda es un medicamento utilizado en el tratamiento de la enfermedad de Alzheimer. Información detallada sobre el uso, la dosis, los efectos secundarios de Namenda.
Nombre de la marca: Namenda
Nombre genérico: clorhidrato de memantina
Namenda (clorhidrato de memantina) es un medicamento utilizado en el tratamiento de la enfermedad de Alzheimer. A continuación encontrará información detallada sobre usos, dosis y efectos secundarios de Namenda.
Contenido:
Descripción
Farmacología
Indicaciones y uso
Contraindicaciones
Precauciones
Interacciones con la drogas
Reacciones adversas
Sobredosis
Dosis
Suministrado
Instrucciones para el paciente
Información del paciente de Namenda (en inglés simple)
Descripción
Namenda® (clorhidrato de memantina) es un antagonista del receptor de NMDA activo por vía oral. El nombre químico del clorhidrato de memantina es clorhidrato de 1-amino-3,5-dimetilamantano con la siguiente fórmula estructural:
Fuente: Forest Laboratories, distribuidor de EE. UU. O Namenda.
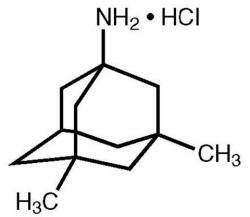
La fórmula molecular es C12H21N · HCl y el peso molecular es 215.76.
La memantina HCl se presenta como un polvo fino de color blanco a blanquecino y es soluble en agua. Namenda está disponible como tabletas o como solución oral. Namenda está disponible para administración oral en forma de cápsula, comprimidos recubiertos con película que contienen 5 mg y 10 mg de clorhidrato de memantina. Las tabletas también contienen los siguientes ingredientes inactivos: celulosa microcristalina, lactosa monohidrato, dióxido de silicio coloidal, talco y estearato de magnesio. Además, los siguientes ingredientes inactivos también están presentes como componentes del recubrimiento de la película: hipromelosa, triacetina, dióxido de titanio, FD&C amarillo # 6 y FD&C azul # 2 (tabletas de 5 mg), negro de óxido de hierro (tabletas de 10 mg). La solución oral de Namenda contiene clorhidrato de memantina en una concentración equivalente a 2 mg de clorhidrato de memantina en cada ml. La solución oral también contiene los siguientes ingredientes inactivos: solución de sorbitol (70%), metil parabeno, propilparabeno, propilenglicol, glicerina, sabor a menta natural # 104, ácido cítrico, citrato de sodio y purificado agua.
Farmacología Clínica
Mecanismo de acción y farmacodinámica.
Activación persistente de los receptores de N-metil-D-aspartato (NMDA) del sistema nervioso central por el Se ha hipotetizado que el glutamato de aminoácidos excitatorios contribuye a la sintomatología de Enfermedad de Alzheimer Se postula que la memantina ejerce su efecto terapéutico a través de su acción como una afinidad baja a moderada antagonista del receptor NMDA no competitivo (canal abierto) que se une preferentemente al receptor NMDA operado por el receptor canales de cationes. No hay evidencia de que la memantina prevenga o retarde la neurodegeneración en pacientes con enfermedad de Alzheimer.
La memantina mostró una afinidad baja a insignificante por los receptores GABA, benzodiazepina, dopamina, adrenérgicos, histamina y glicina y por los canales de Ca 2+, Na + o K + dependientes del voltaje. La memantina también mostró efectos antagonistas en el receptor 5HT 3 con una potencia similar a la de el receptor NMDA y los receptores de acetilcolina nicotínicos bloqueados con un sexto a un décimo del potencia.
Los estudios in vitro han demostrado que la memantina no afecta la inhibición reversible de la acetilcolinesterasa por donepezilo, galantamina o tacrina.
Farmacocinética
La memantina se absorbe bien después de la administración oral y tiene una farmacocinética lineal en el rango de dosis terapéutica. Se excreta predominantemente en la orina, sin cambios, y tiene una vida media de eliminación terminal de aproximadamente 60-80 horas.
Absorción y Distribución
Después de la administración oral, la memantina se absorbe altamente con concentraciones máximas alcanzadas en aproximadamente 3-7 horas. Los alimentos no tienen efecto sobre la absorción de memantina. El volumen medio de distribución de memantina es de 9-11 l / kg y la unión a proteínas plasmáticas es baja (45%).
Metabolismo y Eliminación
La memantina sufre un metabolismo hepático parcial. Alrededor del 48% del fármaco administrado se excreta sin cambios en la orina; el resto se convierte principalmente en tres metabolitos polares que poseen un receptor mínimo de NMDA actividad antagonista: el conjugado de N-glucurónido, 6-hidroxi memantina y 1-nitroso-desaminado memantina Un total del 74% de la dosis administrada se excreta como la suma del fármaco original y el conjugado de N-glucurónido. El sistema enzimático microsómico hepático CYP450 no desempeña un papel significativo en el metabolismo de la memantina. La memantina tiene una vida media de eliminación terminal de aproximadamente 60-80 horas. El aclaramiento renal implica la secreción tubular activa moderada por la reabsorción tubular dependiente del pH.
Poblaciones Especiales
Insuficiencia renal: La farmacocinética de memantina se evaluó después de la administración oral única de 20 mg de memantina HCl en 8 sujetos con insuficiencia renal leve (aclaramiento de creatinina, CLcr,> 50 - 80 ml / min), 8 sujetos con insuficiencia renal moderada (CLcr 30 - 49 ml / min), 7 sujetos con insuficiencia renal grave (CLcr 5 - 29 mL / min) y 8 sujetos sanos (CLcr> 80 mL / min) coincidieron lo más posible por edad, peso y sexo con los sujetos con insuficiencia renal discapacidad. El AUC 0- (infinito) medio aumentó en un 4%, 60% y 115% en sujetos con insuficiencia renal leve, moderada y grave, respectivamente, en comparación con sujetos sanos. La vida media de eliminación terminal aumentó en un 18%, 41% y 95% en sujetos con insuficiencia renal leve, moderada y grave, respectivamente, en comparación con sujetos sanos.
No se recomienda ajustar la dosis en pacientes con insuficiencia renal leve y moderada. La dosis debe reducirse en pacientes con insuficiencia renal grave (ver DOSIS Y ADMINISTRACIÓN).
Mayor: La farmacocinética de Namenda en sujetos jóvenes y ancianos es similar.
Género: Después de la administración de dosis múltiples de Namenda 20 mg b.i.d., las mujeres tuvieron una exposición aproximadamente un 45% mayor que los hombres, pero no hubo diferencia en la exposición cuando se tuvo en cuenta el peso corporal.
Interacciones farmacológicas
Sustratos de enzimas microsomales: Los estudios in vitro indicaron que a concentraciones superiores a las asociadas con la eficacia, la memantina no induce las isoenzimas del citocromo P450 CYP1A2, CYP2C9, CYP2E1 y CYP3A4 / 5. Además, los estudios in vitro han demostrado que la memantina produce una inhibición mínima de las enzimas CYP450 CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 y CYP3A4. Estos datos indican que no se esperan interacciones farmacocinéticas con fármacos metabolizados por estas enzimas.
Inhibidores de enzimas microsomales: Dado que la memantina sufre un metabolismo mínimo, y la mayoría de la dosis se excreta sin cambios en la orina, es poco probable una interacción entre la memantina y los medicamentos que son inhibidores de las enzimas CYP450. La administración conjunta de Namenda con el inhibidor de AChE donepezil HCl no afecta la farmacocinética de ninguno de los compuestos.
Medicamentos eliminados mediante mecanismos renales: La memantina se elimina en parte por la secreción tubular. Los estudios in vivo han demostrado que múltiples dosis de diurético hidroclorotiazida / triamtereno (HCTZ / TA) no afectaron el AUC de memantina en estado estacionario. La memantina no afectó la biodisponibilidad de TA y disminuyó el AUC y la Cmax de HCTZ en aproximadamente un 20%. La administración conjunta de memantina con el medicamento antihipeglucémico Glucovance® (gliburida y metformina HCl) no afectó la farmacocinética de memantina, metformina y gliburida. La memantina no modificó los efectos reductores de la glucosa en suero de Glucovance®, lo que indica la ausencia de una interacción farmacodinámica.
Medicamentos que hacen que la orina sea alcalina.: El aclaramiento de memantina se redujo en aproximadamente un 80% en condiciones de orina alcalina a pH 8. Por lo tanto, las alteraciones del pH de la orina hacia el estado alcalino pueden conducir a una acumulación del medicamento con un posible aumento de los efectos adversos. Se esperaría que los medicamentos que alcalinizan la orina (por ejemplo, inhibidores de la anhidrasa carbónica, bicarbonato de sodio) reduzcan la eliminación renal de memantina.
Fármacos altamente unidos a las proteínas plasmáticas.: Debido a que la unión a proteínas plasmáticas de la memantina es baja (45%), es improbable una interacción con medicamentos que estén altamente unidos a las proteínas plasmáticas, como la warfarina y la digoxina.
ENSAYOS CLÍNICOS
La eficacia de Namenda (clorhidrato de memantina) como tratamiento para pacientes con enfermedad de Alzheimer de moderada a grave se demostró en 2 aleatorizados, Estudios clínicos doble ciego, controlados con placebo (Estudios 1 y 2) realizados en los Estados Unidos que evaluaron tanto la función cognitiva como la función del día a día. La edad media de los pacientes que participaron en estos dos ensayos fue de 76 años con un rango de 50-93 años. Aproximadamente el 66% de los pacientes eran mujeres y el 91% de los pacientes eran caucásicos.
Un tercer estudio (Estudio 3), realizado en Letonia, incluyó pacientes con demencia severa, pero no evaluó la función cognitiva como un punto final planificado.
Medidas de resultado del estudio: en cada estudio de EE. UU., La efectividad de Namenda se determinó utilizando un instrumento diseñado para evaluar la función general a través de la evaluación relacionada con el cuidador, y un instrumento que mide cognición. Ambos estudios mostraron que los pacientes con Namenda experimentaron una mejoría significativa en ambas medidas en comparación con el placebo.
La función diaria se evaluó en ambos estudios utilizando el estudio cooperativo modificado de la enfermedad de Alzheimer - Inventario de actividades de la vida diaria (ADCS-ADL). El ADCS-ADL consta de una batería completa de preguntas sobre ADL que se utilizan para medir las capacidades funcionales de los pacientes. Cada elemento de ADL se clasifica desde el nivel más alto de rendimiento independiente hasta la pérdida completa. El investigador realiza el inventario entrevistando a un cuidador familiarizado con el comportamiento del paciente. Un subconjunto de 19 artículos, que incluyen calificaciones de la capacidad del paciente para comer, vestirse, bañarse, teléfono, viajar, comprar, y realizar otras tareas domésticas ha sido validado para la evaluación de pacientes con moderado a severo demencia. Este es el ADCS-ADL modificado, que tiene un rango de puntuación de 0 a 54, con las puntuaciones más bajas que indican un mayor deterioro funcional.
La capacidad de Namenda para mejorar el rendimiento cognitivo se evaluó en ambos estudios con la batería de discapacidad severa (SIB), un Instrumento de múltiples ítems que ha sido validado para la evaluación de la función cognitiva en pacientes con moderado a severo demencia. El SIB examina aspectos seleccionados del rendimiento cognitivo, incluidos elementos de atención, orientación, lenguaje, memoria, capacidad visoespacial, construcción, praxis e interacción social. El rango de puntuación de SIB es de 0 a 100, con puntuaciones más bajas que indican un mayor deterioro cognitivo.
Estudio 1 (Estudio de veintiocho semanas)
En un estudio de 28 semanas de duración, 252 pacientes con enfermedad de Alzheimer probable de moderada a severa (diagnosticados por DSM-IV y NINCDS-ADRDA criterios, con puntajes de Mini-Mental State Examination> / = 3 y! - = 14 y Global Deterioration Scale Stages 5-6) fueron asignados al azar a Namenda o placebo. Para los pacientes asignados al azar a Namenda, el tratamiento se inició con 5 mg una vez al día y se incrementó semanalmente en 5 mg / día en dosis divididas a una dosis de 20 mg / día (10 mg dos veces al día).
Efectos sobre el ADCS-ADL:
La Figura 1 muestra el curso temporal para el cambio desde el inicio en la puntuación ADCS-ADL para pacientes en los dos grupos de tratamiento que completaron las 28 semanas del estudio. A las 28 semanas de tratamiento, la diferencia media en las puntuaciones de cambio de ADCS-ADL para los pacientes tratados con Namenda en comparación con los pacientes con placebo fue de 3,4 unidades. Utilizando un análisis basado en todos los pacientes y llevando adelante su última observación del estudio (análisis LOCF), el tratamiento con Namenda fue estadísticamente significativamente superior al placebo.
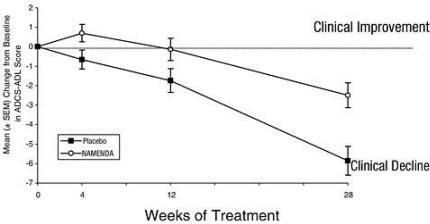
Figura 1: Curso temporal del cambio desde el inicio en la puntuación ADCS-ADL para pacientes que completaron 28 semanas de tratamiento.
La Figura 2 muestra los porcentajes acumulativos de pacientes de cada uno de los grupos de tratamiento que habían alcanzado al menos el cambio en el ADCS-ADL que se muestra en el eje X.
Las curvas muestran que ambos pacientes asignados a Namenda y al placebo tienen una amplia gama de respuestas y, en general, muestran un deterioro (un cambio negativo en ADCS-ADL en comparación con la línea de base), pero es más probable que el grupo de Namenda muestre una disminución menor o un mejora. (En una pantalla de distribución acumulativa, una curva para un tratamiento efectivo se desplazaría a la izquierda de la curva para placebo, mientras que un tratamiento ineficaz o perjudicial se superpondría o desplazaría a la derecha de la curva para placebo.)

Figura 2: Porcentaje acumulado de pacientes que completaron 28 semanas de tratamiento doble ciego con cambios específicos desde el inicio en las puntuaciones de ADCS-ADL.
Efectos sobre el SIB: la Figura 3 muestra el curso temporal para el cambio desde el inicio en el puntaje del SIB para los dos grupos de tratamiento durante las 28 semanas del estudio. A las 28 semanas de tratamiento, la diferencia media en las puntuaciones de cambio de SIB para los pacientes tratados con Namenda en comparación con los pacientes tratados con placebo fue de 5,7 unidades. Usando un análisis LOCF, el tratamiento con Namenda fue estadísticamente significativamente superior al placebo.

Figura 3: Curso temporal del cambio desde el inicio en la puntuación SIB para pacientes que completaron 28 semanas de tratamiento.
La Figura 4 muestra los porcentajes acumulativos de pacientes de cada grupo de tratamiento que habían alcanzado al menos la medida de cambio en la puntuación SIB mostrada en el eje X.
Las curvas muestran que ambos pacientes asignados a Namenda y placebo tienen una amplia gama de respuestas y generalmente muestran deterioro, pero es más probable que el grupo de Namenda muestre una disminución menor o un mejora.
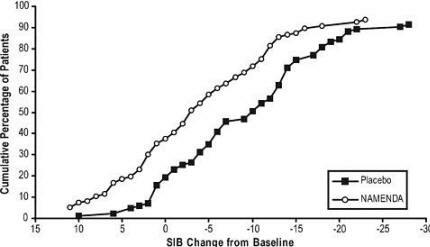
Figura 4: Porcentaje acumulado de pacientes que completaron 28 semanas de tratamiento doble ciego con cambios específicos desde el inicio en las puntuaciones de SIB.
Estudio 2 (Estudio de veinticuatro semanas) En un estudio de 24 semanas de duración, 404 pacientes con moderado a severo probable enfermedad de Alzheimer (diagnosticada por los criterios de NINCDS-ADRDA, con Mini examen del estado mental puntuaciones ≥ 5 y ≤ 14) que habían sido tratados con donepezilo durante al menos 6 meses y que habían recibido una dosis estable de donepezil durante los últimos 3 meses fueron asignados al azar a Namenda o placebo mientras aún recibían donepezil Para los pacientes asignados al azar a Namenda, el tratamiento se inició con 5 mg una vez al día y aumentó semanalmente en 5 mg / día en dosis divididas a una dosis de 20 mg / día (10 mg dos veces al día).
Efectos sobre el ADCS-ADL: la Figura 5 muestra el curso temporal para el cambio desde el inicio en la puntuación ADCS-ADL para los dos grupos de tratamiento durante las 24 semanas del estudio. A las 24 semanas de tratamiento, la diferencia media en las puntuaciones de cambio de ADCS-ADL para Namenda / donepezil Los pacientes tratados (terapia combinada) en comparación con los pacientes tratados con placebo / donepezilo (monoterapia) fueron 1,6 unidades. Usando un análisis LOCF, el tratamiento con Namenda / donepezil fue estadísticamente significativamente superior al placebo / donepezil.
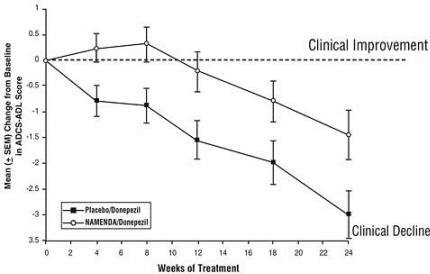
Figura 5: Curso temporal del cambio desde el inicio en la puntuación ADCS-ADL para pacientes que completaron 24 semanas de tratamiento.
La Figura 6 muestra los porcentajes acumulativos de pacientes de cada uno de los grupos de tratamiento que habían alcanzado al menos la medida de mejora en el ADCS-ADL que se muestra en el eje X.
Las curvas muestran que ambos pacientes asignados a Namenda / donepezil y placebo / donepezil tienen una amplia gama de respuestas y generalmente muestran deterioro, pero es más probable que el grupo Namenda / donepezilo muestre una disminución menor o un mejora.
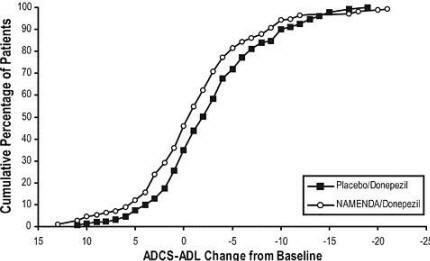
Figura 6: Porcentaje acumulado de pacientes que completaron 24 semanas de tratamiento doble ciego con cambios específicos desde el inicio en las puntuaciones de ADCS-ADL.
Efectos sobre el SIB: la Figura 7 muestra el curso temporal para el cambio desde el inicio en el puntaje SIB para los dos grupos de tratamiento durante las 24 semanas del estudio. A las 24 semanas de tratamiento, la diferencia media en las puntuaciones de cambio de SIB para los pacientes tratados con Namenda / donepezil en comparación con los pacientes tratados con placebo / donepezil fue de 3,3 unidades. Usando un análisis LOCF, el tratamiento con Namenda / donepezil fue estadísticamente significativamente superior al placebo / donepezil.

Figura 7: Curso temporal del cambio desde el inicio en la puntuación SIB para pacientes que completaron 24 semanas de tratamiento.
La Figura 8 muestra los porcentajes acumulados de pacientes de cada grupo de tratamiento que habían alcanzado al menos la medida de mejora en la puntuación SIB mostrada en el eje X.
Las curvas muestran que ambos pacientes asignados a Namenda / donepezil y placebo / donepezil tienen un amplio rango de respuestas, pero es más probable que el grupo Namenda / donepezilo muestre una mejora o una disminución disminución.

Figura 8: Porcentaje acumulado de pacientes que completaron 24 semanas de tratamiento doble ciego con cambios especificados desde el inicio en las puntuaciones de SIB.
Estudio 3 (Estudio de doce semanas) En un estudio doble ciego de 12 semanas de duración, realizado en hogares de ancianos en Letonia, 166 pacientes con demencia según al DSM-III-R, un puntaje de Mini-Mental State Examination de <10, y la clasificación de la Escala de deterioro global de 5 a 7 se asignaron al azar a Namenda o placebo. Para los pacientes asignados al azar a Namenda, el tratamiento se inició con 5 mg una vez al día y aumentó a 10 mg una vez al día después de 1 semana. Las medidas de eficacia principales fueron la subescala de dependencia de la atención de la Escala de calificación conductual para pacientes geriátricos (BGP), una medida de la función del día a día, y una Impresión clínica global de cambio (CGI-C), una medida de la clínica general efecto. No se utilizó una medida válida de la función cognitiva en este estudio. Se observó una diferencia de tratamiento estadísticamente significativa a las 12 semanas que favoreció a Namenda sobre el placebo en ambas medidas de eficacia primarias. Debido a que los pacientes ingresados eran una mezcla de enfermedad de Alzheimer y demencia vascular, se hizo un intento para distinguir los dos grupos y todos los pacientes fueron designados más tarde con demencia vascular o enfermedad de Alzheimer, según sus puntajes en la Escala Isquémica de Hachinski en el estudio entrada. Solo alrededor del 50% de los pacientes tenían tomografía computarizada del cerebro. Para el subconjunto designado como que tiene la enfermedad de Alzheimer, se observó un efecto de tratamiento estadísticamente significativo que favorece a Namenda sobre el placebo a las 12 semanas tanto en el BGP como en el CGI-C.
Indicaciones y uso
Namenda (clorhidrato de memantina) está indicado para el tratamiento de la demencia moderada a severa del tipo Alzheimer.
Contraindicaciones
Namenda (clorhidrato de memantina) está contraindicado en pacientes con hipersensibilidad conocida al clorhidrato de memantina o a cualquier excipiente utilizado en la formulación.
Precauciones
Información para pacientes y cuidadores: Los cuidadores deben recibir instrucciones sobre la administración recomendada (dos veces al día para dosis superiores a 5 mg) y el aumento de la dosis (intervalo mínimo de una semana entre aumentos de dosis).
Convulsiones por condiciones neurológicas:
Namenda no se ha evaluado sistemáticamente en pacientes con un trastorno convulsivo. En los ensayos clínicos de Namenda, se produjeron convulsiones en el 0.2% de los pacientes tratados con Namenda y en el 0.5% de los pacientes tratados con placebo.
Condiciones genitourinarias
Las condiciones que aumentan el pH de la orina pueden disminuir la eliminación urinaria de memantina, lo que resulta en un aumento de los niveles plasmáticos de memantina.
Poblaciones Especiales
Deterioro hepático
Namenda sufre un metabolismo hepático parcial, con aproximadamente el 48% de la dosis administrada excretada en la orina como fármaco inalterado o como la suma del fármaco original y el conjugado de N-glucurónido (74%). La farmacocinética de la memantina en pacientes con insuficiencia hepática no se ha investigado, pero se esperaría que solo se vea levemente afectada.
Insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve o moderada. Se recomienda una reducción de la dosis en pacientes con insuficiencia renal grave (ver FARMACOLOGÍA CLÍNICA y DOSIFICACIÓN Y ADMINISTRACIÓN ).
Interacciones farmacológicas
N-metil-D-aspartato (NMDA) antagonistas: el uso combinado de Namenda con otros antagonistas de NMDA (amantadina, ketamina y dextrometorfano) no se ha evaluado sistemáticamente y dicho uso debe abordarse con precaución.
Efectos de Namenda sobre sustratos de enzimas microsomales: Los estudios in vitro realizados con sustratos marcadores de enzimas CYP450 (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4) mostraron una inhibición mínima de estas enzimas por la memantina. Además, los estudios in vitro indican que a concentraciones superiores a las asociadas con la eficacia, la memantina no induce las isoenzimas del citocromo P450 CYP1A2, CYP2C9, CYP2E1 y CYP3A4 / 5. No se esperan interacciones farmacocinéticas con medicamentos metabolizados por estas enzimas.
Efectos de inhibidores y / o sustratos de enzimas microsomales en Namenda: La memantina se elimina predominantemente por vía renal y no se espera que los medicamentos que son sustratos y / o inhibidores del sistema CYP450 alteren el metabolismo de la memantina.
Inhibidores de la acetilcolinesterasa (AChE): La administración conjunta de Namenda con el inhibidor de AChE donepezil HCl no afectó la farmacocinética de ninguno de los compuestos. En un estudio clínico controlado de 24 semanas en pacientes con enfermedad de Alzheimer de moderada a grave, el efecto adverso El perfil de eventos observado con una combinación de memantina y donepezilo fue similar al del donepezilo solo.
Drogas eliminadas por mecanismos renales: Debido a que la memantina se elimina en parte por la secreción tubular, la administración conjunta de medicamentos que usan el mismo sistema catiónico renal, incluyendo hidroclorotiazida (HCTZ), triamtereno (TA), metformina, cimetidina, ranitidina, quinidina y nicotina, podrían producir niveles plasmáticos alterados de ambos agentes. Sin embargo, la administración conjunta de Namenda y HCTZ / TA no afectó la biodisponibilidad de memantina o TA, y la biodisponibilidad de HCTZ disminuyó en un 20%. Además, la administración conjunta de memantina con el medicamento antihipeglucémico Glucovance® (gliburida y metformina HCl) no afectó la farmacocinética de memantina, metformina y gliburida. Además, la memantina no modificó el efecto reductor de la glucosa en suero de Glucovance®.
Medicamentos que hacen que la orina sea alcalina.: El aclaramiento de memantina se redujo en aproximadamente un 80% en condiciones de orina alcalina a pH 8. Por lo tanto, las alteraciones del pH de la orina hacia la condición alcalina pueden conducir a una acumulación del medicamento con un posible aumento de los efectos adversos. El pH de la orina se ve alterado por la dieta, los medicamentos (por ejemplo, inhibidores de la anhidrasa carbónica, bicarbonato de sodio) y el estado clínico del paciente (por ejemplo, acidosis tubular renal o infecciones graves del tracto urinario). Por lo tanto, la memantina debe usarse con precaución en estas condiciones.
Carcinogénesis, mutagénesis y deterioro de la fertilidad.
No hubo evidencia de carcinogenicidad en un estudio oral de 113 semanas en ratones a dosis de hasta 40 mg / kg / día (10 veces la dosis humana máxima recomendada [MRHD] en mg / m 2). Tampoco hubo evidencia de carcinogenicidad en ratas con dosis orales de hasta 40 mg / kg / día durante 71 semanas. seguido de 20 mg / kg / día (20 y 10 veces el MRHD en una base de mg / m 2, respectivamente) durante 128 semanas.
La memantina no produjo evidencia de potencial genotóxico cuando se evaluó en el S. in vitro. typhimurium o E. ensayo de mutación inversa de coli, una prueba de aberración cromosómica in vitro en linfocitos humanos, un ensayo de citogenética in vivo para detectar daño cromosómico en ratas y el ensayo de micronúcleos de ratón in vivo. Los resultados fueron equívocos en un ensayo de mutación genética in vitro utilizando células V79 de hámster chino.
No se observó deterioro de la fertilidad o el rendimiento reproductivo en ratas administradas hasta 18 mg / kg / día (9 veces la MRHD en un mg / m 2) por vía oral desde 14 días antes del apareamiento hasta la gestación y la lactancia en hembras, o durante 60 días antes del apareamiento en machos
El embarazo
Embarazo Categoría B: La memantina administrada por vía oral a ratas y conejas preñadas durante el período de organogénesis no fue teratogénica hasta las dosis más altas probadas (18 mg / kg / día en ratas y 30 mg / kg / día en conejos, que son 9 y 30 veces, respectivamente, la dosis máxima recomendada en humanos [MRHD] en mg / m 2 base).
Se observó una ligera toxicidad materna, disminución del peso de las crías y una mayor incidencia de vértebras cervicales no osificadas dosis de 18 mg / kg / día en un estudio en el que a las ratas se les administró memantina oral comenzando el apareamiento previo y continuando durante el posparto período. También se observó una ligera toxicidad materna y disminución del peso de los cachorros con esta dosis en un estudio en el que las ratas fueron tratadas desde el día 15 de gestación hasta el período posparto. La dosis sin efecto para estos efectos fue de 6 mg / kg, que es 3 veces la MRHD en mg / m 2.
No existen estudios adecuados y bien controlados de memantina en mujeres embarazadas. La memantina debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Madres lactantes
No se sabe si la memantina se excreta en la leche materna humana. Debido a que muchos medicamentos se excretan en la leche humana, se debe tener precaución cuando se administra memantina a una madre lactante.
Uso pediátrico
No existen ensayos adecuados y bien controlados que documenten la seguridad y la eficacia de la memantina en cualquier enfermedad que ocurra en niños.
Reacciones adversas
La experiencia descrita en esta sección se deriva de estudios en pacientes con enfermedad de Alzheimer y demencia vascular.
Eventos adversos que conducen a la interrupción: En ensayos controlados con placebo en los que los pacientes con demencia recibieron dosis de Namenda de hasta 20 mg / día, el La probabilidad de interrupción debido a un evento adverso fue la misma en el grupo de Namenda que en el placebo grupo. Ningún evento adverso individual se asoció con la interrupción del tratamiento en 1% o más de los pacientes tratados con Namenda y a una tasa mayor que el placebo.
Eventos adversos informados en ensayos controlados: Los eventos adversos informados en los ensayos de Namenda (clorhidrato de memantina) reflejan la experiencia adquirida en condiciones estrechamente controladas en una población de pacientes altamente seleccionados. En la práctica real o en otros ensayos clínicos, estas estimaciones de frecuencia pueden no aplicarse, ya que las condiciones de uso, el comportamiento informativo y los tipos de pacientes tratados pueden diferir. La Tabla 1 enumera los signos y síntomas emergentes del tratamiento que se informaron en al menos el 2% de los pacientes controlados con placebo. ensayos de demencia y para los cuales la tasa de ocurrencia fue mayor para los pacientes tratados con Namenda que para los tratados con placebo. Ningún evento adverso ocurrió con una frecuencia de al menos 5% y el doble de la tasa de placebo.
Sistema corporal |
Placebo (N = 922) % |
Namenda (N = 940) % |
Cuerpo como un todo | ||
Fatiga |
1 | 2 |
Dolor |
1 | 3 |
Sistema cardiovascular | ||
Hipertensión |
2 | 4 |
Sistema nervioso central y periférico | ||
Mareo |
5 | 7 |
Dolor de cabeza |
3 | 6 |
Sistema gastrointestinal | ||
Estreñimiento |
3 | 5 |
Vómitos |
2 | 3 |
Sistema musculoesquelético | ||
Dolor de espalda |
2 | 3 |
Desórdenes psiquiátricos | ||
Confusión |
5 | 6 |
Somnolencia |
2 | 3 |
Alucinación |
2 | 3 |
Sistema respiratorio | ||
Tos |
3 | 4 |
Disnea |
1 | 2 |
Otros eventos adversos que ocurrieron con una incidencia de al menos 2% en pacientes tratados con Namenda pero a una tasa mayor o igual con placebo fueron agitación, caída, lesión infligida, incontinencia urinaria, diarrea, bronquitis, insomnio, infección del tracto urinario, síntomas similares a la gripe, marcha anormal, depresión, infección del tracto respiratorio superior, ansiedad, edema periférico, náuseas, anorexia y artralgia.
El perfil general de los eventos adversos y las tasas de incidencia de eventos adversos individuales en la subpoblación de pacientes con la enfermedad de Alzheimer de moderada a grave no fue diferente del perfil y las tasas de incidencia descritas anteriormente para la demencia general población.
Cambios de signos vitales: Los grupos de Namenda y placebo se compararon con respecto a (1) cambio medio desde el inicio en los signos vitales (pulso, presión arterial sistólica, sangre diastólica presión y peso) y (2) la incidencia de pacientes que cumplen con los criterios de cambios clínicamente significativos desde el inicio en estos variables No hubo cambios clínicamente importantes en los signos vitales en pacientes tratados con Namenda. Una comparación de las medidas de signos vitales en posición supina y permanente para Namenda y placebo en sujetos normales de edad avanzada indicó que el tratamiento con Namenda no está asociado con cambios ortostáticos.
Cambios de laboratorio: Los grupos de Namenda y placebo se compararon con respecto a (1) cambio medio con respecto al valor basal en varios análisis de química, hematología y suero. variables de análisis de orina y (2) la incidencia de pacientes que cumplen criterios para cambios clínicamente significativos desde el inicio en estos variables Estos análisis no revelaron cambios clínicamente importantes en los parámetros de pruebas de laboratorio asociados con el tratamiento con Namenda.
Cambios de ECG: Los grupos de Namenda y placebo se compararon con respecto a (1) cambio medio con respecto al valor basal en varios parámetros de ECG y (2) La incidencia de pacientes que cumplen con los criterios de cambios potencialmente clínicamente significativos desde el inicio en estos variables Estos análisis no revelaron cambios clínicamente importantes en los parámetros de ECG asociados con el tratamiento con Namenda.
Otros eventos adversos observados durante los ensayos clínicos
Namenda se ha administrado a aproximadamente 1350 pacientes con demencia, de los cuales más de 1200 recibieron la dosis máxima recomendada de 20 mg / día. Los pacientes recibieron tratamiento con Namenda durante períodos de hasta 884 días, con 862 pacientes que recibieron al menos 24 semanas de tratamiento y 387 pacientes que recibieron 48 semanas o más de tratamiento.
Tratamiento signos y síntomas emergentes que ocurrieron durante 8 ensayos clínicos controlados y 4 abiertos Los investigadores clínicos registraron los ensayos como eventos adversos utilizando su propia terminología elegir. Para proporcionar una estimación general de la proporción de personas que tienen tipos similares de eventos, los eventos se agruparon en un número menor de categorías estandarizadas usando la terminología de la OMS, y las frecuencias de eventos se calcularon en todos estudios.
Se incluyen todos los eventos adversos que ocurren en al menos dos pacientes, excepto los que ya figuran en la Tabla 1, también términos de la OMS general para ser informativo, los síntomas o eventos menores probablemente no sean causados por drogas, por ejemplo, porque son comunes en el estudio población. Los eventos se clasifican por sistema corporal y se enumeran utilizando las siguientes definiciones: eventos adversos frecuentes: los que ocurren en al menos 1/100 pacientes; eventos adversos poco frecuentes: los que ocurren en 1/100 a 1/1000 pacientes. Estos eventos adversos no están necesariamente relacionados con el tratamiento con Namenda y en la mayoría de los casos se observaron con una frecuencia similar en pacientes tratados con placebo en los estudios controlados.
Cuerpo como un todo: Frecuente: síncope. Poco frecuentes: hipotermia, reacción alérgica.
Sistema cardiovascular: Frecuente: insuficiencia cardíaca. Poco frecuentes: angina de pecho, bradicardia, infarto de miocardio, tromboflebitis, fibrilación auricular, hipotensión, paro cardíaco, hipotensión postural, embolia pulmonar, edema pulmonar.
Sistema nervioso central y periférico: Frecuentes: ataque isquémico transitorio, accidente cerebrovascular, vértigo, ataxia, hipocinesia. Poco frecuentes: parestesia, convulsiones, trastorno extrapiramidal, hipertonía, temblor, afasia, hipoestesia, anormal coordinación, hemiplejia, hipercinesia, contracciones musculares involuntarias, estupor, hemorragia cerebral, neuralgia, ptosis, neuropatía.
Sistema gastrointestinal: Poco frecuentes: gastroenteritis, diverticulitis, hemorragia gastrointestinal, melena, ulceración esofágica.
Trastornos hemáticos y linfáticos.: Frecuentes: anemia. Poco frecuentes: leucopenia.
Trastornos metabólicos y nutricionales: Frecuente: aumento de la fosfatasa alcalina y disminución del peso. Poco frecuentes: deshidratación, hiponatremia, diabetes mellitus agravada.
Desórdenes psiquiátricos: Frecuente: reacción agresiva. Poco frecuentes: delirio, trastorno de la personalidad, labilidad emocional, nerviosismo, trastorno del sueño, aumento de la libido, psicosis, amnesia, apatía, reacción paranoide, pensamiento anormal, llanto anormal, aumento del apetito, paroniria, delirio, despersonalización, neurosis, suicidio intento.
Sistema respiratorio: Frecuentes: neumonía. Poco frecuentes: apnea, asma, hemoptisis.
Piel y apéndices: Frecuente: erupción cutánea. Poco frecuentes: ulceración de la piel, prurito, celulitis, eccema, dermatitis, erupción eritematosa, alopecia, urticaria.
Sentidos especiales: Frecuentes: cataratas, conjuntivitis. Poco frecuentes: degeneración de la mácula lútea, disminución de la agudeza visual, disminución de la audición, tinnitus, blefaritis, visión borrosa, opacidad corneal, glaucoma, hemorragia conjuntival, dolor ocular, hemorragia retiniana, xeroftalmia, diplopía, lagrimeo anormal, miopía, desprendimiento de retina.
Sistema urinario: Frecuente: micción frecuente. Poco frecuentes: disuria, hematuria, retención urinaria.
Eventos informados posteriores a la comercialización de Namenda, tanto de EE. UU. Como de EE. UU.
Aunque no se ha encontrado una relación causal con el tratamiento con memantina, se ha informado que los siguientes eventos adversos están temporalmente asociados con el tratamiento con memantina y no son descrito en otra parte del etiquetado: bloqueo auriculoventricular, fractura ósea, síndrome del túnel carpiano, infarto cerebral, dolor torácico, claudicación, colitis, discinesia, disfagia, gastritis, reflujo gastroesofágico, convulsiones de gran mal, hemorragia intracraneal, insuficiencia hepática, hiperlipidemia, hipoglucemia, íleo, impotencia, malestar general, síndrome neuroléptico maligno, agudo pancreatitis, neumonía por aspiración, insuficiencia renal aguda, intervalo QT prolongado, inquietud, síndrome de Stevens-Johnson, muerte súbita, taquicardia supraventricular, taquicardia, tardía discinesia y trombocitopenia.
TOXICOLOGÍA ANIMAL
La memantina indujo lesiones neuronales (vacuolación y necrosis) en las células multipolares y piramidales en las capas corticales III y IV de la parte posterior neocortices cingulados y retroesplenales en ratas, similares a los que se sabe que ocurren en roedores a los que se administran otros antagonistas de los receptores de NMDA. Se observaron lesiones después de una dosis única de memantina. En un estudio en el que las ratas recibieron dosis orales diarias de memantina durante 14 días, la dosis sin efecto para la necrosis neuronal fue 6 veces la dosis humana máxima recomendada en mg / m 2. Se desconoce el potencial para la inducción de la vacuolación neuronal central y la necrosis por antagonistas de los receptores NMDA en humanos.
ABUSO Y DEPENDENCIA DE DROGAS
Clase de sustancia controlada: Memantine HCl no es una sustancia controlada.
Dependencia física y psicológica: Memantine HCl es un antagonista de NMDA no competitivo de baja a moderada afinidad que no produjo ninguna evidencia de búsqueda de drogas comportamiento o síntomas de abstinencia tras la interrupción en 2,504 pacientes que participaron en ensayos clínicos en terapia dosis Los datos posteriores a la comercialización, fuera de los EE. UU., Recopilados retrospectivamente, no han proporcionado evidencia de abuso o dependencia de drogas.
Sobredosis
Debido a que las estrategias para el manejo de la sobredosis evolucionan continuamente, es aconsejable contactar a un centro de control de intoxicaciones para determinar las últimas recomendaciones para el manejo de una sobredosis de cualquier fármaco.
Como en cualquier caso de sobredosis, se deben utilizar medidas generales de apoyo y el tratamiento debe ser sintomático. La eliminación de memantina se puede mejorar mediante la acidificación de la orina. En un caso documentado de sobredosis con hasta 400 mg de memantina, el paciente experimentó inquietud, psicosis, alucinaciones visuales, somnolencia, estupor y pérdida del conocimiento. El paciente se recuperó sin secuelas permanentes.
Dosificación y administración
La dosis de Namenda (clorhidrato de memantina) que se ha demostrado eficaz en ensayos clínicos controlados es de 20 mg / día.
La dosis inicial recomendada de Namenda es de 5 mg una vez al día. La dosis objetivo recomendada es de 20 mg / día. La dosis debe aumentarse en incrementos de 5 mg a 10 mg / día (5 mg dos veces al día), 15 mg / día (5 mg y 10 mg como dosis separadas) y 20 mg / día (10 mg dos veces al día). El intervalo mínimo recomendado entre aumentos de dosis es de una semana.
Namenda puede tomarse con o sin comida.
Los pacientes / cuidadores deben recibir instrucciones sobre cómo usar el dispositivo de dosificación de solución oral de Namenda. Deben estar al tanto de la hoja de instrucciones para el paciente que se adjunta con el producto. Se debe indicar a los pacientes / cuidadores que respondan cualquier pregunta sobre el uso de la solución a su médico o farmacéutico.
Dosis en poblaciones especiales
Se recomienda una dosis objetivo de 5 mg BID en pacientes con insuficiencia renal grave (aclaramiento de creatinina de 5 - 29 ml / min según la ecuación de Cockroft-Gault):
Para hombres: CLcr = [140 años (años)] · Peso (kg) / [72 · creatinina sérica (mg / dL)]
Para mujeres: CLcr = 0.85 · [140 años (años)] · Peso (kg) / [72 · creatinina sérica (mg / dL)]
Cómo suministrado
Tableta de 5 mg:
Botella de 60 NDC # 0456-3205-60
10 × 10 dosis de la unidad NDC # 0456-3205-63
Las tabletas recubiertas con película en forma de cápsula son de color tostado, con la resistencia (5) grabada en un lado y FL en el otro.
Tableta de 10 mg:
Botella de 60 NDC # 0456-3210-60
10 × 10 dosis de la unidad NDC # 0456-3210-63
Las tabletas recubiertas con película en forma de cápsula son grises, con la resistencia (10) grabada en un lado y FL en el otro.
Paquete de titulación:
Blister de PVC / Aluminio que contiene 49 tabletas. 28 × 5 mg y 21 × 10 mg comprimidos. NDC # 0456-3200-14
Los comprimidos recubiertos con película en forma de cápsula de 5 mg son de color canela, con la resistencia (5) grabada en un lado y FL en el otro. Los comprimidos recubiertos con película en forma de cápsula de 10 mg son grises, con la resistencia (10) grabada en un lado y FL en el otro.
Solucion Oral:
Las recomendaciones de dosificación para la solución oral son las mismas que para las tabletas. La solución oral es transparente, sin alcohol, sin azúcar y con sabor a menta.
Solución oral de 2 mg / ml (10 mg = 5 ml)
12 fl. onz. (360 ml) botella NDC # 0456-3202-12
Almacenar a 25 ° C (77 ° F); excursiones permitidas a 15-30 ° C (59-86 ° F) [consulte Temperatura ambiente controlada de USP].
Forest Pharmaceuticals, Inc.
Filial de Forest Laboratories, Inc.
St. Louis, MO 63045
Con licencia de Merz Pharmaceuticals GmbH
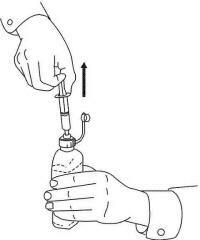
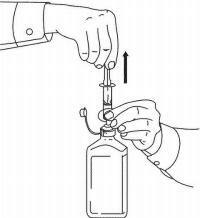
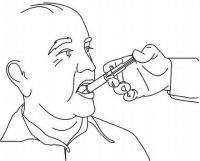
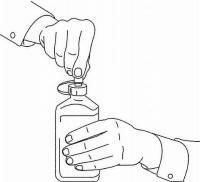
INSTRUCCIONES PARA EL PACIENTE DE NAMENDA® Solución oral
Siga las instrucciones a continuación para usar su dispositivo de dosificación de solución oral Namenda®.
IMPORTANTE: Lea estas instrucciones antes de usar la solución oral de Namenda®.
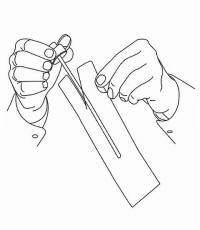 |
|
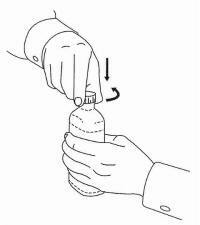 |
|
 |
|
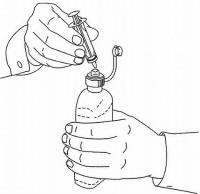 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
IMPORTANTE: La información de esta monografía no pretende abarcar todos los usos, instrucciones, precauciones, interacciones farmacológicas o efectos adversos posibles. Esta información es generalizada y no pretende ser un consejo médico específico. Si tiene preguntas sobre los medicamentos que está tomando o desea obtener más información, consulte con su médico, farmacéutico o enfermero. Última actualización 4/07.
Fuente: Forest Laboratories, distribuidor estadounidense de Namenda.
Información del paciente de Namenda (en inglés simple)
de regreso: Página de inicio de farmacología de medicamentos psiquiátricos



